填空题 适中0.65 引用1 组卷595
硫单质及其化合物在工农生产中有着重要的应用,请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ·mol-1
②1/4CaSO4(s)+CO(g)=1/4CaS(s)+CO2(g) △H=-47.3kJ·mol-1
反应:CaO(s)+3CO(g)+SO2(g)=CaS(s)+3CO2(g) △H=_____________ kJ·mol-1
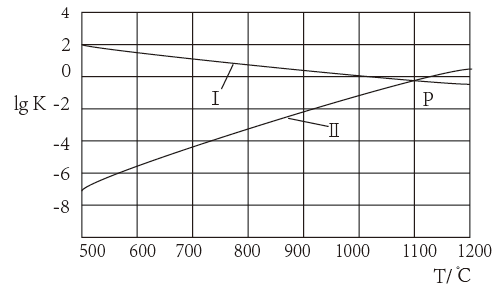
(2)下图为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系。
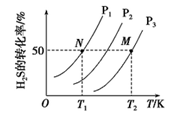
该反应平衡常数的大小关系为K(T1)____ K(T2)(填“>”、“=”或“<”),理由是____ 。用各物质的平衡分压代替平衡浓度表示反应的平衡常数,记为Kp,计算该反应在T1温度下的Kp=_________ (用p1表示)。
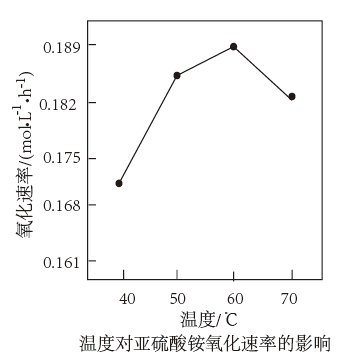
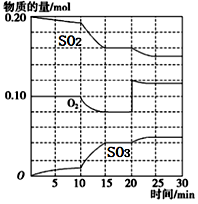
(3)在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g) 2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是
2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是________________ (用文字表达);10min到15min的曲线变化的原因可能是________ (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO2的物质的量
(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=__________________ (用含硫微粒浓度的代数式表示)。
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ·mol-1
②1/4CaSO4(s)+CO(g)=1/4CaS(s)+CO2(g) △H=-47.3kJ·mol-1
反应:CaO(s)+3CO(g)+SO2(g)=CaS(s)+3CO2(g) △H=
(2)下图为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系。

该反应平衡常数的大小关系为K(T1)
(3)在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)
 2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是
2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO2的物质的量

(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=
2018·陕西西安·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
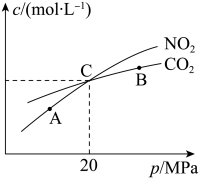
 N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
 CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJ•mol-1