解答题-原理综合题 较难0.4 引用1 组卷281
亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)⇌2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)⇌2ClNO(g) K3
则K3=__________ (用K1、K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
则反应2NO(g)+Cl2(g)⇌2ClNO(g)的ΔH和a的关系为ΔH=_______________ kJ/mol。
(3)300℃时,2NO(g)+Cl2(g)⇌2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
n=________________ ;k=__________________________ 。
(4)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:
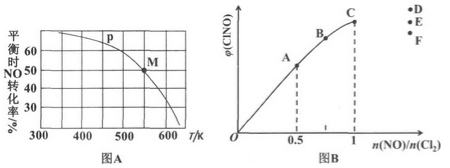
①在p压强条件下,M点时容器内NO的体积分数为______________ 。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________ (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B所示,则A、B、C三状态中,NO的转化率最大的是______________ 点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________ 点。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)⇌2ClNO(g) K3
则K3=
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
| 化学键 | N≡O (NO) | Cl-Cl | Cl-N | N=O |
| 键能/(kJ/mol) | 630 | 243 | a | 607 |
则反应2NO(g)+Cl2(g)⇌2ClNO(g)的ΔH和a的关系为ΔH=
(3)300℃时,2NO(g)+Cl2(g)⇌2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
| 序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
| ① | 0.30 | 0.36 |
| ② | 0.60 | 1.44 |
| ③ | 0.90 | 3.24 |
n=
(4)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①在p压强条件下,M点时容器内NO的体积分数为
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B所示,则A、B、C三状态中,NO的转化率最大的是
18-19高二上·黑龙江大庆·期中
类题推荐
亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g) 2NOCl(g)。
2NOCl(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g)
NaNO3(s)+NOCl(g)
②4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
③2NO(g)+Cl2(g) 2NOCl(g)
2NOCl(g)
设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为___________ 。
(2)300℃时,2NOCl(g) 2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为带有单位的速率常数,其值只与温度有关),测得速率与浓度的关系如表所示:
2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为带有单位的速率常数,其值只与温度有关),测得速率与浓度的关系如表所示:
n=___________ ,k=___________ 。
(3)在1L恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(NOC1)与时间t的关系如图A所示:___________ mol·L-1·min-1。
②T2温度下反应的平衡常数K为___________ 。
③T2温度下Cl2的平衡转化率为___________ 。
(4)若按投料比n(NO):n(Cl2)=2:1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图B所示:
①该反应的△H___________ (填“>”“<”或“=”)0。
②在p压强条件下,M点对应温度下,达到平衡时容器内NO的体积分数为___________ 。
③若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=___________ (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s)
②4NO2(g)+2NaCl(s)
③2NO(g)+Cl2(g)
设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为
(2)300℃时,2NOCl(g)
| 序号 | c(NOCl)/mol·L-1 | v正/mol·L-1·s-1 |
| ① | 0.30 | 3.60×10-9 |
| ② | 0.60 | l。44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
(3)在1L恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(NOC1)与时间t的关系如图A所示:
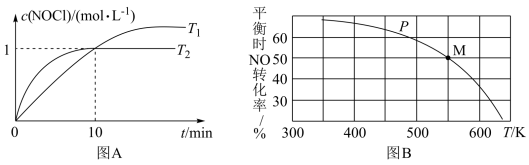
②T2温度下反应的平衡常数K为
③T2温度下Cl2的平衡转化率为
(4)若按投料比n(NO):n(Cl2)=2:1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图B所示:
①该反应的△H
②在p压强条件下,M点对应温度下,达到平衡时容器内NO的体积分数为
③若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=
I.亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应 获得。
获得。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①
②
③
则K3=___________ (用K1和K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为 );
);
则反应 的
的 =
=___________ (用含a的代数式表示)。
(3)按投料比 把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO转化率与温度T、压强p(总压)的关系如图所示:
把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO转化率与温度T、压强p(总压)的关系如图所示:
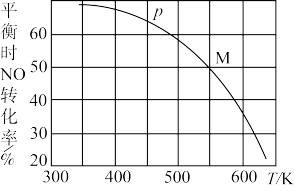
若反应一直保持在压强为p的条件下进行,则M点的压强平衡常数Kp=___________ (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 体积分数)。
体积分数)。
II.一种熔融碳酸盐燃料电池原理示意如图。请回答下列问题:
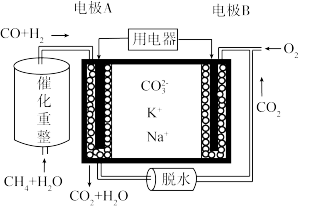
(4)反应 ,每消耗1molCH4理论上转移电子的物质的量
,每消耗1molCH4理论上转移电子的物质的量___________ 。
(5)电池工作时,CO 向电极
向电极___________ (填“A”或“B”)移动。
(6)电极B上发生的电极反应为___________ 。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①
②
③
则K3=
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为
| 化学键 | Cl—Cl | Cl—N | N=O | |
| 键能/(kJ/mol) | 630 | 243 | a | 607 |
(3)按投料比

若反应一直保持在压强为p的条件下进行,则M点的压强平衡常数Kp=
II.一种熔融碳酸盐燃料电池原理示意如图。请回答下列问题:

(4)反应
(5)电池工作时,CO
(6)电极B上发生的电极反应为
亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)  2NOCl(g)。
2NOCl(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g) K1
NaNO3(s)+NOCl(g) K1
②4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) 2NOCl(g) K3
2NOCl(g) K3
反应①②③对应的平衡常数依次为K1、K2、K3,则K3与K1、K2之间的关系为_________ 。
(2)300℃时,2NOCl(g) 2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为
2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为带有单位 的速率常数,其值只与温度有关),测得速率与浓度的关系如表所示:
n=_________ ,k=_________ 。
(3)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入一定量NO和 Cl2合成NOCl,方程式为2NO(g)+Cl2(g) 2NOCl(g) △H 若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图1曲线a所示,则 △H
2NOCl(g) △H 若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图1曲线a所示,则 △H _________ (填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图1曲线b所示,则改变的条件是_________ 。
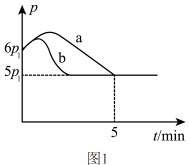
(4)若把2molNO和1molCl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图2所示,若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=_________ (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。

(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s)
②4NO2(g)+2NaCl(s)
③2NO(g)+Cl2(g)
反应①②③对应的平衡常数依次为K1、K2、K3,则K3与K1、K2之间的关系为
(2)300℃时,2NOCl(g)
| 序号 | c(NOCl)/mol·L-1 | v正/mol·L-1·s-1 |
| ① | 0.30 | 3.60×10-9 |
| ② | 0.60 | l.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
(3)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入一定量NO和 Cl2合成NOCl,方程式为2NO(g)+Cl2(g)

(4)若把2molNO和1molCl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图2所示,若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


