填空题 适中0.65 引用1 组卷83
(1)依据事实,写出下列反应的热化学方程式。
①在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为:___________________________________________ 。
②若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量__________________ 。
③已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为:________________________________ 。
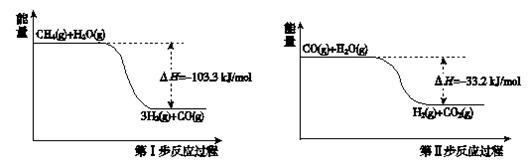
(2)氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是____________ 。
②第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为____ ,CO的平衡转化率为_____ 。
①在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为:
②若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量
③已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为:
(2)氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:

①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是
②第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为
18-19高二上·陕西西安·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CO(g)+H2(g)+H2O(g)
CO(g)+H2(g)+H2O(g)

