解答题-实验探究题 适中0.65 引用1 组卷121
I.(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,则量筒中液体的体积是①,由于放置位置不当读数时俯视,读出的数值为②则①②的正确数值为___________
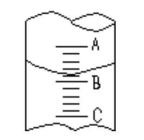
A①3.2mL、②小于3.2mL B.①4.8mL、②大于4.8mL
C.①3.2mL、②大于3.2mL D.①4.8mL、②小于4.8mL
(2)实验室需配制1mol·L-1的NaOH溶液200mL,在用托盘天平称取NaOH固体时,天平读数为________ 填代号,下同)。
A.大于8.0g B.小于8.0g C.8.0g
II.表示溶液浓度的方法通常有两种;溶液中溶质的质量分数(W)和物质的量浓度 (c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
(1)用10%(密度为1.01g/cm3)的氢氧化钠溶液配制成27.5g 2%的氢氧化钠溶液。
①计算:需_________ g 10%(密度为1.01g/cm3)的氢氧化钠溶液
②量取:用_________ mL量筒量取10%的氢氧化钠溶液
(2)把98%(密度为1.84g/cm3)的浓硫酸稀释成2mol/L的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸_______ mL
②下列实验操作使配制的溶液浓度偏的是__________
A.容量瓶洗涤后未干燥
B.量取溶液时,仰视刻度线
C.装入试剂瓶时,有少量溶液溅出
D.没有洗涤烧杯和玻璃棒
E.定容时,加水不慎超出刻度线,又倒出一些

A①3.2mL、②小于3.2mL B.①4.8mL、②大于4.8mL
C.①3.2mL、②大于3.2mL D.①4.8mL、②小于4.8mL
(2)实验室需配制1mol·L-1的NaOH溶液200mL,在用托盘天平称取NaOH固体时,天平读数为
A.大于8.0g B.小于8.0g C.8.0g
II.表示溶液浓度的方法通常有两种;溶液中溶质的质量分数(W)和物质的量浓度 (c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
(1)用10%(密度为1.01g/cm3)的氢氧化钠溶液配制成27.5g 2%的氢氧化钠溶液。
①计算:需
②量取:用
(2)把98%(密度为1.84g/cm3)的浓硫酸稀释成2mol/L的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸
②下列实验操作使配制的溶液浓度偏的是
A.容量瓶洗涤后未干燥
B.量取溶液时,仰视刻度线
C.装入试剂瓶时,有少量溶液溅出
D.没有洗涤烧杯和玻璃棒
E.定容时,加水不慎超出刻度线,又倒出一些
18-19高一上·吉林·期中
知识点:一定物质的量浓度的溶液的配制配制一定物质的量浓度的溶液的步骤、操作配制一定物质的量浓度的溶液实验的误差分析配制一定物质的量浓度的溶液实验的仪器 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


