解答题-原理综合题 适中0.65 引用1 组卷419
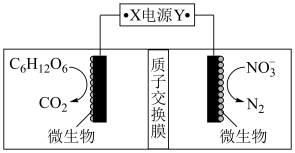
(1)世界水产养殖协会介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。请写出阴极的电极反应式 _________________________ 。
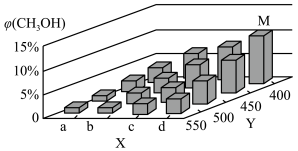
(2)甲醇可利用水煤气合成:CO(g)+2H2(g) CH3OH(g) △H<0. 一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后CH3OH的体积分数 φCH3OH)变化趋势如图所示。下列说法正确的是
CH3OH(g) △H<0. 一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后CH3OH的体积分数 φCH3OH)变化趋势如图所示。下列说法正确的是___________ 。

A.状态M,平衡时的CO转化率为10%
B.图中压强的大小关系是a<b<c<d
C.恒温恒压时,在原平衡体系中再充入适量甲醇,重新平衡后体系中甲醇的体积分数不变
D.当体系中 n(CO)/n(H2)的值不随时间变化时,体系达到平衡
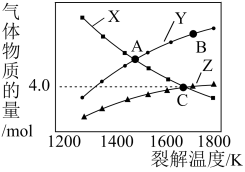
(3)二氧化硫和碘水会发生如下二步反应:
一定条件下,1mol SO2分别加入到体积相同、浓度不同的碘水中,体系达到平衡后,H+、I3—、SO42—的物质的量随n(I2)/n(SO2)的变化曲线如图 (忽略反应前后的体积变化)。
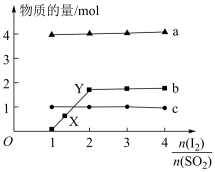
①有人认为X点的I—浓度小于Y点,你认为该观点是否正确________ ,原因是_________________ 。
②当n(I2)/n(SO2)=4时,请在下图画出体系中n (I—)反应时间的变化曲线。________

③化学兴趣小组拟采用下述方法来测定I2+I— I3—的平衡常数(室温条件下进行,实验中溶液体积变化忽略不计):
I3—的平衡常数(室温条件下进行,实验中溶液体积变化忽略不计):
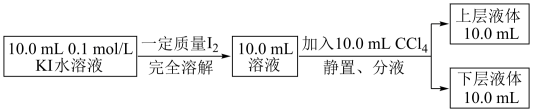
已知:I—和I3—不溶于CCl4;:一定温度下,碘单质在四氯化碳和水混合液体中,碘单质的浓度比值 即是一个常数(用Kd表示,称为分配系数),室温条件下 Kd=85。实验测得上层溶液中c(I3—)=0.049mol/L,下层液体中c(I2)=0.085mol·L-1。结合上述数据,计算室温条件下I2+ I—
即是一个常数(用Kd表示,称为分配系数),室温条件下 Kd=85。实验测得上层溶液中c(I3—)=0.049mol/L,下层液体中c(I2)=0.085mol·L-1。结合上述数据,计算室温条件下I2+ I— I3—的平衡常数K=
I3—的平衡常数K=_______ (保留三位有效数字)。

(2)甲醇可利用水煤气合成:CO(g)+2H2(g)
 CH3OH(g) △H<0. 一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后CH3OH的体积分数 φCH3OH)变化趋势如图所示。下列说法正确的是
CH3OH(g) △H<0. 一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后CH3OH的体积分数 φCH3OH)变化趋势如图所示。下列说法正确的是
A.状态M,平衡时的CO转化率为10%
B.图中压强的大小关系是a<b<c<d
C.恒温恒压时,在原平衡体系中再充入适量甲醇,重新平衡后体系中甲醇的体积分数不变
D.当体系中 n(CO)/n(H2)的值不随时间变化时,体系达到平衡
(3)二氧化硫和碘水会发生如下二步反应:
| 反应 | 活化能 | |
| 第一步 | SO2+I2+2H2O 4H++SO42—+2I— 4H++SO42—+2I— | 9.2kJ·mol-1 |
| 第二步 | I2+ I— I3— I3— | 23.5kJ·mol-1 |
一定条件下,1mol SO2分别加入到体积相同、浓度不同的碘水中,体系达到平衡后,H+、I3—、SO42—的物质的量随n(I2)/n(SO2)的变化曲线如图 (忽略反应前后的体积变化)。

①有人认为X点的I—浓度小于Y点,你认为该观点是否正确
②当n(I2)/n(SO2)=4时,请在下图画出体系中n (I—)反应时间的变化曲线。

③化学兴趣小组拟采用下述方法来测定I2+I—
 I3—的平衡常数(室温条件下进行,实验中溶液体积变化忽略不计):
I3—的平衡常数(室温条件下进行,实验中溶液体积变化忽略不计):
已知:I—和I3—不溶于CCl4;:一定温度下,碘单质在四氯化碳和水混合液体中,碘单质的浓度比值
 I3—的平衡常数K=
I3—的平衡常数K=2019·浙江嘉兴·一模
类题推荐
甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
则该反应的ΔH=________ kJ/mol。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
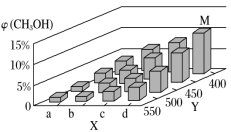
①下列说法不能判断该反应达到化学平衡状态的是________ 。
A.体系中气体的密度保持不变
B.CO的消耗速率与CH3OH的消耗速率相等
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________ 。
③某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________ 。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式__________________ 。
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
①该反应的平衡常数K=_____________ 。
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线_______________ 。

(1)制取甲胺的反应为CH3OH(g)+NH3(g)
 CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:| 共价键 | C—O | H—O | N—H | C—N |
| 键能/(kJ/mol) | 351.5 | 463 | 393 | 293 |
则该反应的ΔH=
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)
 CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①下列说法不能判断该反应达到化学平衡状态的是
A.体系中气体的密度保持不变
B.CO的消耗速率与CH3OH的消耗速率相等
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
③某同学认为上图中Y轴表示温度,你认为他判断的理由是
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)
 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| HI体积分数 | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
①该反应的平衡常数K=
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线

二氧化碳与氢气催化合成甲醇,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)已知:
计算上述反应的△H=_________________ kJ.mol-1。
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达平衡的是______________________ (填选项字母)。
A.容器内气体密度保持不变
B.CO2的体积分数保持不变
C.H2O(g)与CO2(g)的生成速率之比为1∶1
D.该反应的平衡常数保持不变
E.混合气体的平均相对分子质量不变
F.容器中压强保持不变
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制“图1”:
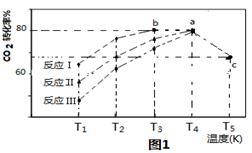
(T5时,图1中C点转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是_______________ (填“反应I”,“反应II”,“反应III”)。
②T3的b点v(正)_____________ v(逆)(填 “>”, “<”, “="”" )。
③T4的a点转化率比T5的c点高的原因是________________________ 。
④在温度为T5时,该反应的平衡常数K=__________________________ 。
⑤在温度为T5时,CH3OH的浓度随时间变化的趋势如“图2”所示。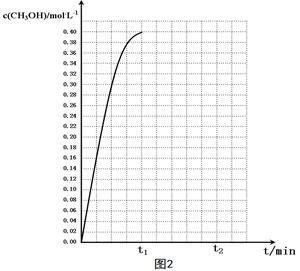
当时间到达t1时,将生成的甲醇和水同时除去,并维持该温度,在 t2时达新平衡。
请在“图2”中画出t1时刻后CH3OH的浓度变化总趋势曲线。
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)(1)已知:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| 键能/kJ·mol-1 | 436 | 326 | 803 | 464 | 414 |
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达平衡的是
A.容器内气体密度保持不变
B.CO2的体积分数保持不变
C.H2O(g)与CO2(g)的生成速率之比为1∶1
D.该反应的平衡常数保持不变
E.混合气体的平均相对分子质量不变
F.容器中压强保持不变
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制“图1”:
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |

(T5时,图1中C点转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是
②T3的b点v(正)
③T4的a点转化率比T5的c点高的原因是
④在温度为T5时,该反应的平衡常数K=
⑤在温度为T5时,CH3OH的浓度随时间变化的趋势如“图2”所示。

当时间到达t1时,将生成的甲醇和水同时除去,并维持该温度,在 t2时达新平衡。
请在“图2”中画出t1时刻后CH3OH的浓度变化总趋势曲线。
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网