解答题-实验探究题 适中0.65 引用1 组卷255
二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。其制备方法有:
(1)方法一:用氯酸钠(NaClO3)和硫酸酸化的H2O2反应生成ClO2。请写出该反应的化学方程式___________________________________________ 。
(2)方法二:用氯酸钠氧化浓盐酸,生成二氧化氯的同时会有氯气产生。请写出该反应的化学方程式_____________________________________ 。
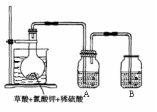
(3)方法三、
①如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),
然后再加入足量的稀硫酸,水浴加热。反应后产物中有
ClO2、CO2和一种酸式盐,该反应的化学方程式为:__________________________________ ,
氧化产物与还原产物的物质的量之比为____________ 。
②控制水浴温度在60~80℃之间的目的是_______________________ ,
图示装置中缺少的一种必须的玻璃仪器是____________ 。
③A装置用于吸收产生的二氧化氯,其中最好盛放________ 。(填序号)①60 ℃的温水 ②冰水 ③饱和食盐水
④将足量二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式_______________________ 。
(1)方法一:用氯酸钠(NaClO3)和硫酸酸化的H2O2反应生成ClO2。请写出该反应的化学方程式
(2)方法二:用氯酸钠氧化浓盐酸,生成二氧化氯的同时会有氯气产生。请写出该反应的化学方程式

(3)方法三、
①如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),
然后再加入足量的稀硫酸,水浴加热。反应后产物中有
ClO2、CO2和一种酸式盐,该反应的化学方程式为:
氧化产物与还原产物的物质的量之比为
②控制水浴温度在60~80℃之间的目的是
图示装置中缺少的一种必须的玻璃仪器是
③A装置用于吸收产生的二氧化氯,其中最好盛放
④将足量二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式
19-20高三上·新疆乌鲁木齐·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
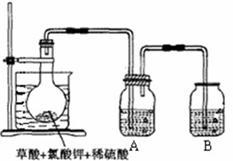
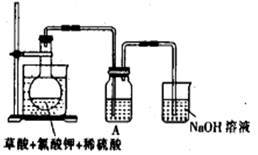
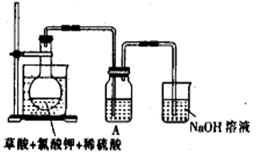
 2KHSO4+2ClO2↑+2CO2↑+2H2O。
2KHSO4+2ClO2↑+2CO2↑+2H2O。

