解答题-原理综合题 适中0.65 引用2 组卷193
氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g) 2NO(g) ΔH=+183 kJ/mol
2NO(g) ΔH=+183 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=-1164.4 kJ/mol
则N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=______ kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为_______ 。
②按投料Ⅱ进行反应,起始时反应进行的方向为________ (填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________ (填“变大”、“变小”或“不变”)。
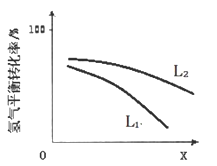
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
ⅰ X代表的物理量是______ 。
ⅱ 判断L1、L2的大小关系,并简述理由______ 。
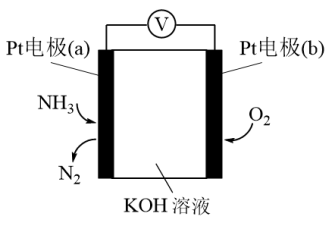
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
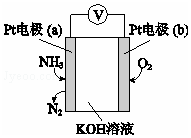
①电极b上发生的是______ 反应(填“氧化”或“还原”)。
②写出电极a的电极反应式_________ 。
(1)已知25℃时:N2(g)+O2(g)
 2NO(g) ΔH=+183 kJ/mol
2NO(g) ΔH=+183 kJ/mol2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=-1164.4 kJ/mol
则N2(g)+3H2(g)
 2NH3(g) ΔH=
2NH3(g) ΔH=(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
| N2 | H2 | NH3 | |
| 投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
| 投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为
②按投料Ⅱ进行反应,起始时反应进行的方向为
③若升高温度,则合成氨反应的化学平衡常数
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

ⅰ X代表的物理量是
ⅱ 判断L1、L2的大小关系,并简述理由
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:

①电极b上发生的是
②写出电极a的电极反应式
17-18高二下·北京朝阳·期末
类题推荐
合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
已知:N2(g)+3H2(g)⇌2NH3(g) ΔH1=−akJ·mol-1
O2(g)+2H2(g)=2H2O(l) ΔH2=−bkJ·mol-1
(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是___________ 。
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下H2的转化率为___________ ,平衡常数K=___________ (可用分数表示)。
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为___________ (填“正向”、“逆向”或“无法判断”)。
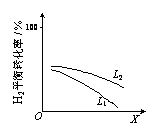
③L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

i.X代表的物理量是___________ 。
ii.判断L1、L2的大小关系,并简述理由___________ 。
(3)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图所示,则a极的电极反应式为___________ 。
已知:N2(g)+3H2(g)⇌2NH3(g) ΔH1=−akJ·mol-1
O2(g)+2H2(g)=2H2O(l) ΔH2=−bkJ·mol-1
(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
| 物质 | N2 | H2 | NH3 |
| 平衡时物质的量/mol | 0.2 | 0.6 | 0.2 |
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为
| 物质 | N2 | H2 | NH3 |
| 起始浓度(mol/L) | 0.5 | 1.5 | 0.5 |

i.X代表的物理量是
ii.判断L1、L2的大小关系,并简述理由
(3)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图所示,则a极的电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网