填空题 较难0.4 引用1 组卷423
25℃时,电离平衡常数:
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________ 。
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol·L﹣1 d.加入少量冰醋酸
(2)等物质的量浓度的Na2CO3、NaClO、CH3COONa、NaHCO3的pH由大到小的顺序是____________ 。
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___________ 。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
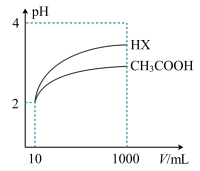
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示.则HX的电离平衡常数____________ (填“大于”、“等于”或“小于”)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)______________ 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=_________________ (填准确数值)。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol·L﹣1 d.加入少量冰醋酸
(2)等物质的量浓度的Na2CO3、NaClO、CH3COONa、NaHCO3的pH由大到小的顺序是
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示.则HX的电离平衡常数

(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=
17-18高二上·福建福州·期末
类题推荐
25℃时,电离平衡常数:
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO﹣+H+△H>0,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是___________ 。
a.加入少量0.10mol·L﹣1的稀盐酸
b.加热
c.加水稀释至0.010mol·L﹣1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10mol·L﹣1的NaOH溶液
(2)向0.1mol/L醋酸溶液中加入水,电离平衡向_____ 移动(填“左”或“右”);n(CH3COOH)___________ ;c(CH3COO-)/c(H+)___________ (填“增大”、“减小”或“不变”);
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___________ 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(4)500mL0.1mol/L醋酸溶液a和500mL0.1mol/L盐酸溶液b与足量Zn粉反应,初始速率a_______ b;生成H2的量a___________ b;完全中和这两种酸,消耗NaOH的量a_________ b(填“<”、“>”或“=”)。
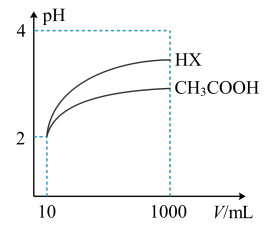
(5)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图。则HX的电离平衡常数___________ (填“大于”、“等于”或“小于”)醋酸溶液。稀释后,HX溶液中水电离出来的c(H+)___________ 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)
(6)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=___________ (填准确数值)。
(7)某溶液含两种相同物质的量的溶质,且其中只存在OH﹣、H+、NH 、Cl﹣四种离子,且c(NH
、Cl﹣四种离子,且c(NH )>c(Cl﹣)>c(OH﹣)>c(H+),则这两种溶质是
)>c(Cl﹣)>c(OH﹣)>c(H+),则这两种溶质是___________ 。
(8)0.1mol·L-1的氨水与0.05mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:___________ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO﹣+H+△H>0,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
a.加入少量0.10mol·L﹣1的稀盐酸
b.加热
c.加水稀释至0.010mol·L﹣1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10mol·L﹣1的NaOH溶液
(2)向0.1mol/L醋酸溶液中加入水,电离平衡向
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(4)500mL0.1mol/L醋酸溶液a和500mL0.1mol/L盐酸溶液b与足量Zn粉反应,初始速率a
(5)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图。则HX的电离平衡常数

(6)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=
(7)某溶液含两种相同物质的量的溶质,且其中只存在OH﹣、H+、NH
(8)0.1mol·L-1的氨水与0.05mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:
25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为________________________ 。
(2)同浓度的CH3COO−、HCO3-、CO32-、ClO−结合H+的能力由强到弱的顺序为________________ 。
(3)常温下0.1 mol⋅L−1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___ 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH−)
D.c(OH−)/c(H+) E.[c(CH3COO−).c(H+)]/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是_____________ 。
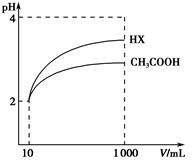
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则相同条件下HX的电离平衡常数________ (填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________ ,稀释后,HX溶液中由水电离出来的c(H+)________ (填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+),理由是_______________________ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10−5 | K1=4.3×10−7 K2=5.6×10−11 | 3.0×10−8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
(2)同浓度的CH3COO−、HCO3-、CO32-、ClO−结合H+的能力由强到弱的顺序为
(3)常温下0.1 mol⋅L−1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH−)
D.c(OH−)/c(H+) E.[c(CH3COO−).c(H+)]/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则相同条件下HX的电离平衡常数

已知25℃时,部分弱电解质的电离平衡常数如表所示:
回答下列问题:
(1)写出H2CO3的第一级电离平衡常数表达式:Ka1__ 。
(2)等物质的量浓度的a.CH3COONa溶液、b.NaCN溶液、c.Na2CO3溶液的pH由大到小的顺序为___ (填字母)
(3)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___ (填字母)。
A.c(H+) B. C.c(H+)•c(OH-) D.
C.c(H+)•c(OH-) D. 
(4)一定温度下,体积均为100mL、pH=2的CH3COOH溶液与一元酸HX溶液,加水稀释过程中溶液pH与体积的关系如图所示,则HX的电离平衡常数____ (填“大于”“小于”或“等于”,下同)CH3COOH的电离平衡常数。稀释相同倍数后,HX溶液中由水电离出的c(H+)___ CH3COOH溶液中由水电离出的c(H+)。

(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=___ mol•L-1(填精确值)。
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数/(mol•L-1) | 1.7×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)写出H2CO3的第一级电离平衡常数表达式:Ka1
(2)等物质的量浓度的a.CH3COONa溶液、b.NaCN溶液、c.Na2CO3溶液的pH由大到小的顺序为
(3)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
A.c(H+) B.
(4)一定温度下,体积均为100mL、pH=2的CH3COOH溶液与一元酸HX溶液,加水稀释过程中溶液pH与体积的关系如图所示,则HX的电离平衡常数

(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


