解答题-原理综合题 较难0.4 引用1 组卷87
氮及其化合物在工业生产中有广泛用。
(1)稀硝酸与二价活泼金属M反应制备硝酸盐,当反应物之比n(HNO3)∶n(M)=5∶2时,还原产物为___ (填化学式)。
(2)连二次硝酸(HO-N=N-OH)是一种二元弱酸,向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色 ,用离子方程式表示其主要原因:__________________ 。
(3)已知以下热化学方程式: 2N2O5(g) 4NO2(g)+O2(g) ΔH1
4NO2(g)+O2(g) ΔH1
2NO(g)+O2(g)=2NO2(g) ΔH2
3NO2(g) N2O5(g)+NO(g) ΔH3
N2O5(g)+NO(g) ΔH3
①ΔH3=______________________ (用ΔH1、ΔH2表示)。
②一定温度下,在恒容密闭容器中进行反应:3NO2(g) N2O5(g)+NO(g),下列表明反应已达到平衡状态的是
N2O5(g)+NO(g),下列表明反应已达到平衡状态的是________ 。
A.容器内总压强保持不变 B.容器内气体密度保持不变
C.v正(NO2)∶v逆(N2O5)=3∶1 D. 保持不变
保持不变
(4)在密闭容器中充入NO,发生反应2NO(g) N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
①ΔH________ 0。(填“>”“<”或“=”)
②上述反应达到平衡之后,仅缩小容器体积,下列推断正确的是_________ 。
A.NO的浓度不再变化
B.NO的转化率不再变化
C.正、逆反应速率不再变化
D.容器内气体压强不再变化
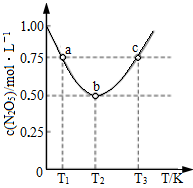
(5)在2 L恒容密闭容器中投入一定量的N2O5(g),发生反应:2N2O5(g) 4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为
4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为_________ 。若平衡时温度不变,再向容器中充入少量的N2O5气体,达到新平衡时N2O5的转化率会_________ (填“增大”“减小”或“不变”)。
(1)稀硝酸与二价活泼金属M反应制备硝酸盐,当反应物之比n(HNO3)∶n(M)=5∶2时,还原产物为
(2)连二次硝酸(HO-N=N-OH)是一种二元弱酸,向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色 ,用离子方程式表示其主要原因:
(3)已知以下热化学方程式: 2N2O5(g)
 4NO2(g)+O2(g) ΔH1
4NO2(g)+O2(g) ΔH12NO(g)+O2(g)=2NO2(g) ΔH2
3NO2(g)
 N2O5(g)+NO(g) ΔH3
N2O5(g)+NO(g) ΔH3①ΔH3=
②一定温度下,在恒容密闭容器中进行反应:3NO2(g)
 N2O5(g)+NO(g),下列表明反应已达到平衡状态的是
N2O5(g)+NO(g),下列表明反应已达到平衡状态的是A.容器内总压强保持不变 B.容器内气体密度保持不变
C.v正(NO2)∶v逆(N2O5)=3∶1 D.
 保持不变
保持不变(4)在密闭容器中充入NO,发生反应2NO(g)
 N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。①ΔH
②上述反应达到平衡之后,仅缩小容器体积,下列推断正确的是
A.NO的浓度不再变化
B.NO的转化率不再变化
C.正、逆反应速率不再变化
D.容器内气体压强不再变化
(5)在2 L恒容密闭容器中投入一定量的N2O5(g),发生反应:2N2O5(g)
 4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为
4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为
17-18高二下·贵州遵义·阶段练习
类题推荐
氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一,
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-l
2C(s)+O 2(g)=2CO(g) ΔH=-221kJ·mol-l
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 ___________ 。
(2)N2O5在一定条件下可发生分解:2N2O5(g) 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
①反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0= ___________ ;2.00min~5.00 min内,O2的平均反应速率为___________ 。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___________ 。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g) 2NO2(g) ΔH=QkJ·mol-1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) ΔH=QkJ·mol-1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
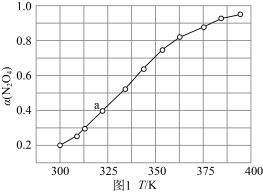
如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=___________ (小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
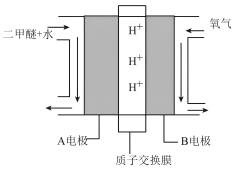
(4)绿色电源“直接二甲醚CH3OCH3(g)燃料电池”的工作原理示意图如图所示:正极为___________ (填“A电极”或“B电极”),写出A电极的电极反应式:___________ 。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-l
2C(s)+O 2(g)=2CO(g) ΔH=-221kJ·mol-l
若某反应的平衡常数表达式为:K=
(2)N2O5在一定条件下可发生分解:2N2O5(g)
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g)

如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=
(4)绿色电源“直接二甲醚CH3OCH3(g)燃料电池”的工作原理示意图如图所示:正极为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1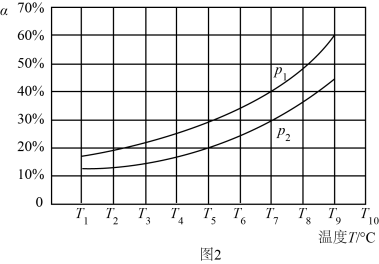
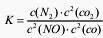 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式  4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:



