解答题-工业流程题 适中0.65 引用1 组卷76
亚氯酸钠(NaClO2)是一种高效漂白剂,工业设计生产NaClO2的主要流程如下:
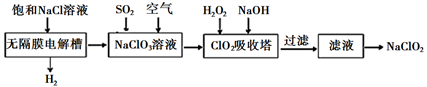
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应方程式:____________________________ 。
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为______________ (写酸的名称)。
(3)ClO2吸收塔中发生反应的离子方程式为______________ ,H2O2的电子式为______________ 。
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②__________________ ;③__________________ ;④__________________ ,得到成品。
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L−1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。
已知:2I2 + 2Na2S2O3 2NaI + Na2S4O6。取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为
2NaI + Na2S4O6。取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为_____________ g·L−1(杂质不参与反应,NaClO2中的氯元素被还原为Cl−)。

已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应方程式:
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为
(3)ClO2吸收塔中发生反应的离子方程式为
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L−1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。
已知:2I2 + 2Na2S2O3
 2NaI + Na2S4O6。取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为
2NaI + Na2S4O6。取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为2018高三·全国·专题练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网