解答题-实验探究题 适中0.65 引用1 组卷255
某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。
实验Ⅰ
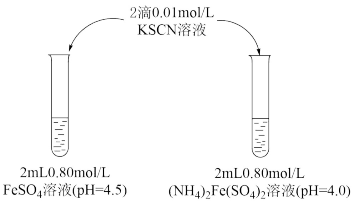
(1)溶液的稳定性:FeSO4_______ (NH4)2Fe(SO4)2(填“>”或“<”)
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因____________ 。
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
(4)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验III:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O 4Fe(OH)3+8H+。
4Fe(OH)3+8H+。
由实验III,乙同学可得出的结论是___________ ,原因是__________________ 。
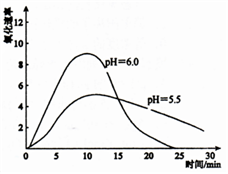
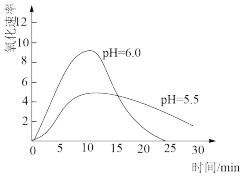
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____________ 。
(6)综合以上实验,增强Fe2+稳定性的措施有_________________ 。
实验Ⅰ

| 物质 | 0 min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
| 操作 | 现象 |
| 取 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O
由实验III,乙同学可得出的结论是
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是

(6)综合以上实验,增强Fe2+稳定性的措施有
17-18高一下·北京·期中
类题推荐
硫酸亚铁(FeSO4)和硫酸亚铁铵[(NH4)2Fe(SO4)2]都是在生产、生活中有重要用途的亚铁盐,探究其饱和溶液稳定性的实验如下:先分别配制FeSO4、(NH4)2Fe(SO4)2饱和溶液,测定pH分别为4.46、4.22,后续实验如图所示。
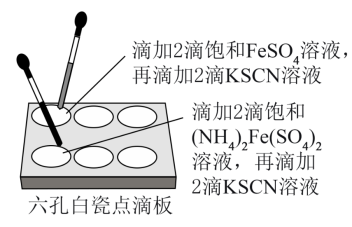
实验结果如表:
回答下列问题:
(1)用白瓷点滴板做上述对比实验的主要优点是____ (答出两条)。
(2)由该实验可以得出两种饱和溶液的稳定性:FeSO4____ (NH4)2Fe(SO4)2(填“大于”“小于”或“等于”,下同),物质的量浓度:FeSO4____ (NH4)2Fe(SO4)2。
(3)FeSO4饱和溶液需要新配制,若久置会发黄、变浑浊,且pH减小,发生反应的离子方程式为____ 。
(4)影响溶液中Fe2+稳定性的因素可提出3种假设。
假设1: 的存在使溶液中Fe2+稳定性增强。
的存在使溶液中Fe2+稳定性增强。
假设2:_____ 使溶液中Fe2+稳定性增强。
假设3:H+浓度增大使溶液中Fe2+稳定性增强。
假设1的依据是 具有一定的还原性,对Fe2+有保护作用,判断该观点是否合理并说明理由
具有一定的还原性,对Fe2+有保护作用,判断该观点是否合理并说明理由____ 。
(5)实验测得相同浓度的FeSO4溶液在不同pH条件下,Fe2+的损耗量%与pH的关系及Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。
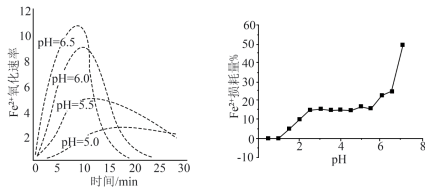
据图分析,开始时Fe2+氧化速率较小,随着产物的生成,速率明显加快,说明产物对反应有催化作用,起催化作用的产物是____ (填化学式),其催化活性最强的pH范围是____ (填标号)。
A.0~1 B.2~2.4 C.2.4~5.5 D.5.5~7
从趋势上看,pH越小,Fe2+损耗量越小的原因是____ 。

实验结果如表:
| 硫酸亚铁和硫酸亚铁铵饱和溶液稳定性对比实验研究 | |||||||
| 溶质 | 0min | 1min | 15min | 60min | 3h | 5h | 24h |
| FeSO4 | 淡淡的桔黄色 | 桔红色 | 红色 | 红色 | 深红 | 深红 | 深红 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 米色 | 米色 | 浅黄 | 黄色 | 桔红 | 桔红 |
(1)用白瓷点滴板做上述对比实验的主要优点是
(2)由该实验可以得出两种饱和溶液的稳定性:FeSO4
(3)FeSO4饱和溶液需要新配制,若久置会发黄、变浑浊,且pH减小,发生反应的离子方程式为
(4)影响溶液中Fe2+稳定性的因素可提出3种假设。
假设1:
假设2:
假设3:H+浓度增大使溶液中Fe2+稳定性增强。
假设1的依据是
(5)实验测得相同浓度的FeSO4溶液在不同pH条件下,Fe2+的损耗量%与pH的关系及Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。

据图分析,开始时Fe2+氧化速率较小,随着产物的生成,速率明显加快,说明产物对反应有催化作用,起催化作用的产物是
A.0~1 B.2~2.4 C.2.4~5.5 D.5.5~7
从趋势上看,pH越小,Fe2+损耗量越小的原因是
Ⅰ.资料1:铁肥有利于叶绿素的合成,能使作物更好的进行光合作用,当作物缺铁后,叶片中叶绿素会减少,从而导致叶片失绿黄化。虽然铁在土壤中的丰度很高,但大多以生物有效性低的氧化态形式存在,特别是在石灰性土壤上,高pH和高重碳酸盐含量严重降低了土壤中铁的有效性。
资料2:部分植物吸收铁元素的系统主要通过3个蛋白酶系统进行:①H+-ATPase蛋白酶系统通过分泌大量的氢离子而使土壤酸化,使难溶性的Fe(OH)3溶解释放Fe3+。②由Fe3+螯合还原酶 (FRO)和NADPH脱氢酶组成Fe3+还原系统,释放的Fe3+与植物体内的螯合剂形成螯合物后自由进出细胞质体,由还原系统将Fe3+螯合物转换释放成Fe2+螯合物。③Fe2+转运蛋白 (IRT)系统能将Fe2+螯合物跨膜运输到根部,再由其他转运蛋白输送到各个细胞供机体利用。
(1)由信息可知,植物生长过程中直接吸收利用下列铁肥,效果最好的是___________
(2)酸性条件下,下列试剂可将Fe3+转化为Fe2+的试剂是___________
(3)某实验小组在欲检测土壤中铁元素的价态,请给出合理的实验方法:
①土壤中是否存在Fe3+___________ 。
②土壤中是否存在Fe2+___________ 。
Ⅱ.为研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。

实验Ⅰ
(4)溶液的稳定性:FeSO4___________ (NH4)2Fe(SO4)2(填“>”或“<”) 。
(5)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH 保护了Fe2+,因为NH
保护了Fe2+,因为NH 具有还原性。进行实验Ⅱ,否定了该观点,补全该实验。
具有还原性。进行实验Ⅱ,否定了该观点,补全该实验。
操作:取___________ ,加___________ ,观察。
现象:与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。
(6)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ。分别配制0.80mol•L-1pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O 4Fe(OH)3+8H+。由实验III,乙同学可得出的结论是
4Fe(OH)3+8H+。由实验III,乙同学可得出的结论是___________ ,原因是___________ 。
Ⅲ.硫酸亚铁在我国北方是一种常见铁肥,施用时铁肥(FeSO4)与钾肥(K2CO3)不能同时施用,丙同学展开实验探究其原因。向2mL 1mol/LFeSO4中逐滴滴加1mol/LK2CO3溶液,观察到立即产生白色沉淀,迅速变成灰绿色,没有观察到其他现象。
资料:①FeCO3是白色固体。
②H2CO3需要达到一定浓度才能以CO2形式逸出。
(7)根据实验现象,说明不同时施用的原因是___________ 。
(8)用化学用语描述沉淀颜色变化的原因___________ 。
(9)请你作为科学宣讲团,从化学角度为农民保存和施用铁肥提出建议(答出2点):___________ 、___________ 。
资料2:部分植物吸收铁元素的系统主要通过3个蛋白酶系统进行:①H+-ATPase蛋白酶系统通过分泌大量的氢离子而使土壤酸化,使难溶性的Fe(OH)3溶解释放Fe3+。②由Fe3+螯合还原酶 (FRO)和NADPH脱氢酶组成Fe3+还原系统,释放的Fe3+与植物体内的螯合剂形成螯合物后自由进出细胞质体,由还原系统将Fe3+螯合物转换释放成Fe2+螯合物。③Fe2+转运蛋白 (IRT)系统能将Fe2+螯合物跨膜运输到根部,再由其他转运蛋白输送到各个细胞供机体利用。
(1)由信息可知,植物生长过程中直接吸收利用下列铁肥,效果最好的是___________
| A.FeSO4 | B.Fe2(SO4)3 | C.Fe(OH)3 | D.[Fe(H2NCONH2)6](NO3)3 |
(2)酸性条件下,下列试剂可将Fe3+转化为Fe2+的试剂是___________
| A.H2O2 | B.KI | C.S | D.H2S |
(3)某实验小组在欲检测土壤中铁元素的价态,请给出合理的实验方法:
①土壤中是否存在Fe3+
②土壤中是否存在Fe2+
Ⅱ.为研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。

实验Ⅰ
| 物质 | 0 min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(4)溶液的稳定性:FeSO4
(5)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH
操作:取
现象:与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。
(6)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ。分别配制0.80mol•L-1pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O
Ⅲ.硫酸亚铁在我国北方是一种常见铁肥,施用时铁肥(FeSO4)与钾肥(K2CO3)不能同时施用,丙同学展开实验探究其原因。向2mL 1mol/LFeSO4中逐滴滴加1mol/LK2CO3溶液,观察到立即产生白色沉淀,迅速变成灰绿色,没有观察到其他现象。
资料:①FeCO3是白色固体。
②H2CO3需要达到一定浓度才能以CO2形式逸出。
(7)根据实验现象,说明不同时施用的原因是
(8)用化学用语描述沉淀颜色变化的原因
(9)请你作为科学宣讲团,从化学角度为农民保存和施用铁肥提出建议(答出2点):
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
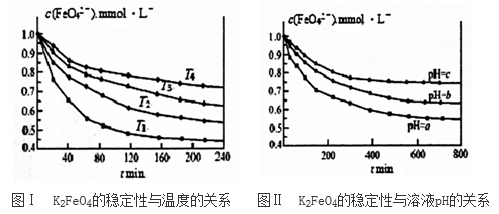
 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。