解答题-实验探究题 适中0.65 引用1 组卷285
资料显示:久置于潮湿环境中的漂白粉受热生成O2和少量Cl2;干燥的漂白粉加热后发生反应Ca(ClO)2 CaCl2 + O2↑。
CaCl2 + O2↑。
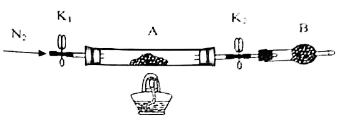
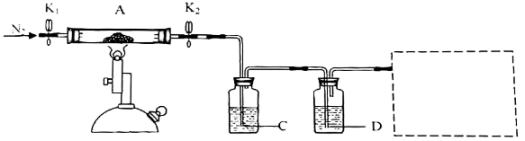
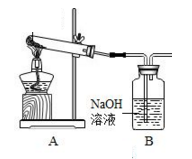
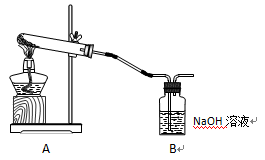
学生甲利用下图装置进行实验:加热A中试管内装有的潮湿漂白粉样品时,观察到B中有大量气泡产生。
(1)B中发生反应的离子方程式为__________________________________________________ 。
(2)请写出实验室检验氯气的方法:_____________________________________________ 。
学生乙设计实验测定某干燥漂白粉样品中次氯酸钙的百分含量。实验步骤如下:
①称量坩埚的质量,为W1g。
②坩埚中加入样品后再称,质量为W2g。
③重复进行加热、冷却、称量,直到恒重,质量为W3g。
(3)称量所用仪器名称为_____________________ ;实验到达恒重的判断依据是___________________________________________________ 。
(4)该漂白粉样品中次氯酸钙的百分含量为_________________ (用W1、W2、W3表示);若所用坩埚内壁沾有受热易分解的物质,则该实验测得的结果__________________ 。(选填“偏大”、“偏小”或“无影响”)
 CaCl2 + O2↑。
CaCl2 + O2↑。学生甲利用下图装置进行实验:加热A中试管内装有的潮湿漂白粉样品时,观察到B中有大量气泡产生。

(1)B中发生反应的离子方程式为
(2)请写出实验室检验氯气的方法:
学生乙设计实验测定某干燥漂白粉样品中次氯酸钙的百分含量。实验步骤如下:
①称量坩埚的质量,为W1g。
②坩埚中加入样品后再称,质量为W2g。
③重复进行加热、冷却、称量,直到恒重,质量为W3g。
(3)称量所用仪器名称为
(4)该漂白粉样品中次氯酸钙的百分含量为
2018·上海·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网