解答题-原理综合题 适中0.65 引用1 组卷249
【小题1】钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)钼酸钠晶体(Na2MoO4·2H20)可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。Na2MoO4中Mo的化合价为____ 。在碱性条件下,将钼精矿(主要成分为MoS2)加入NaClO溶液中,也可以制备钼酸钠,该反应的离子方程式为________ 。
(2)已知:
①2Mo(s)+3O2(g)=2MoO3(s)△H1
②2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g)△H2
③MoS2(s)+2O2(g)=Mo(s)+2SO2(g)△H3
则△H3=_________ (用含△H1、△H2的代数式表示)。
【小题1】(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为:MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。
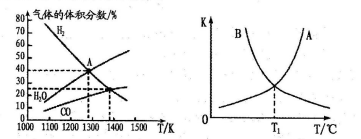
图1:温度与平衡时气体成分的关系 图2:正、逆反应的平衡常数(K)与温度(T)的关系
①一定温度下,在体积为固定的密闭容器中进行上述反应,下列能说明反应达到了平衡状态的是____ (填序号)。
A.2v正(H2)=v逆(CO)
B.CO体积分数保持不变
C.混合气体的平均相对分子质量不再变化
D.△H不再变化
②图1中A点对应的平衡常数Kp=__ (已知A点压强为0.lMPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③综合上述分析得到:图2中,其中表示逆反应的平衡常数(K逆)的曲线是____ (填“A”或“B”),T1对应的平衡常数为____ 。
(1)钼酸钠晶体(Na2MoO4·2H20)可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。Na2MoO4中Mo的化合价为
(2)已知:
①2Mo(s)+3O2(g)=2MoO3(s)△H1
②2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g)△H2
③MoS2(s)+2O2(g)=Mo(s)+2SO2(g)△H3
则△H3=
【小题1】(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为:MoS2(s)+4H2(g)+2Na2CO3(s)
 Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)△H。实验测得平衡时的有关变化曲线如图所示。
图1:温度与平衡时气体成分的关系 图2:正、逆反应的平衡常数(K)与温度(T)的关系
①一定温度下,在体积为固定的密闭容器中进行上述反应,下列能说明反应达到了平衡状态的是
A.2v正(H2)=v逆(CO)
B.CO体积分数保持不变
C.混合气体的平均相对分子质量不再变化
D.△H不再变化
②图1中A点对应的平衡常数Kp=
③综合上述分析得到:图2中,其中表示逆反应的平衡常数(K逆)的曲线是
2018·江西南昌·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
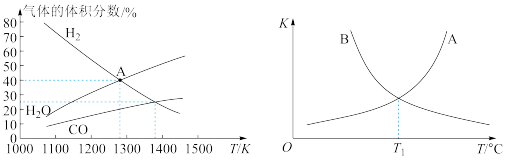
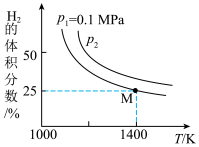
 Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示: