解答题-原理综合题 适中0.65 引用2 组卷334
亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为__________ 。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g) 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
则n=_________ ;k=___________ 。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
则该温度下,ΔH3=______ kJ/mol;K3=______ (用K1和K2表示)。
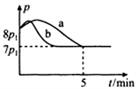
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______ (填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)的变化如图曲线b所示,则改变的条件是_____________ ;K3=___________ L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________ (填“增大”、“减小”或“不变”)。
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)
 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:| 序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
| ① | 0.30 | 3.60×10-9 |
| ② | 0.60 | 1.44×10-8 |
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
| 序号 | 热化学方程式 | 平衡常数 |
| ① | 2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g) ΔH1=a kJ/mol NaNO3(s)+NOCl(g) ΔH1=a kJ/mol | K1 |
| ② | 4NO2(g)+2NaCl(s) 2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ/mol 2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ/mol | K2 |
| ③ | 2NO(g)+Cl2(g) 2NOCl(g) ΔH3 2NOCl(g) ΔH3 | K3 |
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=

2018·四川广安·三模
类题推荐
(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
则该温度下上述反应③的平衡常数表达式为K3=_____________ 。
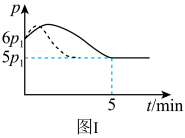
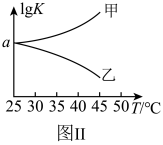
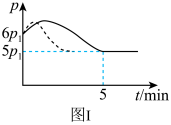
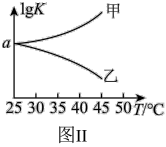
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3___ (填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________ ;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________ (填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______ (填“甲”或“乙”),a值为__________ 。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________ v逆(填“>”“<”或“=”)
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g) CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
| 热化学方程式 | 平衡常数 | |
| ① | 2NO2(g)+NaCl(s) | K1 |
| ② | 4NO2(g)+2NaCl(s) | K2 |
| ③ | 2NO(g)+Cl2(g) | K3 |
则该温度下上述反应③的平衡常数表达式为K3=
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3


(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)
回答下列问题:
(1)亚硝酰氯( )气体是有机合成的重要试剂,它可由Cl2和NO在通常条件下反应制得,
)气体是有机合成的重要试剂,它可由Cl2和NO在通常条件下反应制得, △H,相关化学键的键能如下表所示:
△H,相关化学键的键能如下表所示:
该反应的△H为___________ 。
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04mol Cl2发生上述反应,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则△H3<0,原因是___________ ;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图I虚线所示,则改变的条件是___________ ;在5min时,再充入0.08mol NO和0.04mol Cl2,则混合气体的平均相对分子质量将___________ (填“增大”、“减小”或“不变”)。
(3)图Ⅱ是甲、乙两同学描绘上述反应的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是___________ (填“甲”或“乙”),a值为___________ 。25℃时测得反应在某时刻, 、
、 、
、 的浓度分别为0.7、0.1、0.3,则此时
的浓度分别为0.7、0.1、0.3,则此时
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(1)亚硝酰氯(
| 化学键 | ||||
| 键能/( kJ∙mol-1) | 243 | 630 | 200 | 607 |
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04mol Cl2发生上述反应,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则△H3<0,原因是

(3)图Ⅱ是甲、乙两同学描绘上述反应的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2NOCl(g),25℃时,在体积为2L的恒容密闭容器中通入0.08molNO和0.04molCl2发生上述反应,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,
2NOCl(g),25℃时,在体积为2L的恒容密闭容器中通入0.08molNO和0.04molCl2发生上述反应,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,



