解答题-原理综合题 适中0.65 引用1 组卷248
能源是人类生存、社会发展不可或缺的物质,CO、H2、CH3OH均是重要的能源物质。
(1)已知:氧气中化学键的键能为497 kJ/ mol,二氧化碳中C=O键的键能为745 kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ/mol
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41 kJ/mol
CH3OH(g)+ O2(g)==CO2(g)+2H2O(g) △H3=-660 kJ/mol
O2(g)==CO2(g)+2H2O(g) △H3=-660 kJ/mol
CO(g)+2H2(g) CH3OH(g) △H4
CH3OH(g) △H4
则使1 mol CO(g)完全分解成原子所需要的能量至少为___ ,△H4=___ 。
(2)某密闭容器中存在反应:CO(g)+2H2(g) CH3OH(g),起始时容器中只有a mol/L CO和b mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有a mol/L CO和b mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
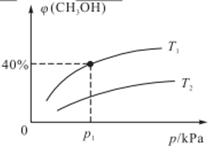
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1____ K2(填“>”“<”“=”);若恒温(T1)恒容条件下,起始时a=1、b=2,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=___ 。 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)
②若恒温恒容条件下,起始时充入1 mol CO和2 mol H2,达平衡后,CO的转化率为α1,此时,若再充入1 mol CO和2 mol H2,再次达平衡后,CO的转化率为α2,则α1_____ α2 (填“>”“<”“=”“无法确定”)
③若恒温恒容条件下,起始时a=1、b=2,则下列叙述能说明反应达到化学平衡状态的是____ 。
A. CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.混合气体的平均摩尔质量不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离常数K=1.8×10-5,则所得到的NH4HCO3溶液中c(NH4+)_____ c(HCO3-)(填“>”“<”“=”)。
(1)已知:氧气中化学键的键能为497 kJ/ mol,二氧化碳中C=O键的键能为745 kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ/mol
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41 kJ/mol
CH3OH(g)+
CO(g)+2H2(g)
 CH3OH(g) △H4
CH3OH(g) △H4则使1 mol CO(g)完全分解成原子所需要的能量至少为
(2)某密闭容器中存在反应:CO(g)+2H2(g)
 CH3OH(g),起始时容器中只有a mol/L CO和b mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有a mol/L CO和b mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1
②若恒温恒容条件下,起始时充入1 mol CO和2 mol H2,达平衡后,CO的转化率为α1,此时,若再充入1 mol CO和2 mol H2,再次达平衡后,CO的转化率为α2,则α1
③若恒温恒容条件下,起始时a=1、b=2,则下列叙述能说明反应达到化学平衡状态的是
A. CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.混合气体的平均摩尔质量不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离常数K=1.8×10-5,则所得到的NH4HCO3溶液中c(NH4+)
2018·安徽合肥·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网