解答题-实验探究题 较难0.4 引用1 组卷152
三氯氧磷(POCl3)是一种重要的化工原料,工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3,2PCl3+O2=2POCl3,PCl3、POCl3的部分性质如下:
某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去) :
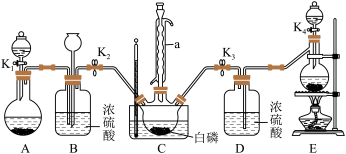
(1)仪器a 的名称为_______________ ,B装置中长颈漏斗的作用是___________________ 。
(2)装置E用来制取Cl2,反应的离子方程式为_____________________ 。
(3)为使实验顺利进行,还需补充的装置为____________________ 。
(4)反应时,需严格控制三个条件:
①先制取___________ ,缓慢地通入C 中,直至C 中的白磷消失后,再通入另一种气体。
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是________ 。
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为___________ (写化学式)。
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为_______________ (写出计算式)。
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
(已知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)
| 熔点/℃ | 沸点/℃ | 其他 | |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |

(1)仪器a 的名称为
(2)装置E用来制取Cl2,反应的离子方程式为
(3)为使实验顺利进行,还需补充的装置为
(4)反应时,需严格控制三个条件:
①先制取
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
(已知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)
2018·山西吕梁·一模
类题推荐
三氯氧磷(POCl3)是一种重要的化工原料,工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3,2PCl3+O2=2POCl3,POCl3的部分性质如下:
某兴趣小组模拟该工艺设计实验装置如图(某些夹持装置、加热装置已略去):

(1)装置A用来制氧气,在常温下通常用黑色固体和液态物质反应。写出A中的化学反应方程式__ 。
(2)B装置的作用除干燥O2外,还有___ 、__ 。
(3)装置E用来制取Cl2,反应的离子方程式为___ 。
(4)反应时,需严格控制三个条件:
①先制取Cl2,缓慢地通入C中,直至C中的白磷消失后,再通入O2。
②C装置用水浴加热控制温度为60~65℃,除加快反应速率外,另一目的是__ 。
③反应物必须干燥,否则会在C装置中产生大量的白雾,其主要成分为__ (写化学式)。
(5)为使实验顺利进行,球形冷凝管a上口还需补充的装置为__ 。
| 熔点/℃ | 沸点/℃ | 其他 | |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |

(1)装置A用来制氧气,在常温下通常用黑色固体和液态物质反应。写出A中的化学反应方程式
(2)B装置的作用除干燥O2外,还有
(3)装置E用来制取Cl2,反应的离子方程式为
(4)反应时,需严格控制三个条件:
①先制取Cl2,缓慢地通入C中,直至C中的白磷消失后,再通入O2。
②C装置用水浴加热控制温度为60~65℃,除加快反应速率外,另一目的是
③反应物必须干燥,否则会在C装置中产生大量的白雾,其主要成分为
(5)为使实验顺利进行,球形冷凝管a上口还需补充的装置为
工业上可以直接氧化PCl3制备POCl3。某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去):

部分物质的性质如下表:
实验步骤如下
I.连接仪器,检查装置气密性。关闭K1、K2打开K3、K4,点燃酒精灯制备气体。
II.缓慢向C中通入适量气体至C中白磷消失,熄灭酒精灯。
III.关闭K3、K4,打开K1、K2,A中开始发生反应。
IV.C装置控制反应在60℃~65℃,最终制得POCl3产品。
回答下列问题:
(1)B、D装置中盛放的试剂是_______ ,B装置的作用除了干燥O2和平衡气压之外,还有_______ 。
(2)仪器a的名称是_______ ,装置E 中发生反应的离子方程式为_____________ 。
(3)步骤IV 控制温度60℃~65℃,其主要目的是_____________ 。
(4)该实验装置存在一处明显的设计缺陷是_______________ 。
(5)通过下面步骤可以测定三氯氧磷产品中Cl 的含量:
I.取xg产品于锥形瓶中,加入足量NaOH 溶液,PCl3完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L 的AgNO3溶液40.00 mL,使Cl-完全沉淀。
III.向其中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
(已知: Ag3PO4溶于酸,Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12)
①滴定选用的指示剂是_______ (填标号)
a.酚酞 b.淀粉 c.NH4Fe(SO4)2d.甲基橙
②元素Cl的质量分数为(列出算式)_________________ 。
③步骤III若不加入硝基苯,所测Cl含量将会_______ (填“偏大”、“偏小”或“不变”)。

部分物质的性质如下表:
| 熔点/℃ | 沸点/℃ | 其他 | |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3,缓慢通入氧气POCl3产率较高 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
I.连接仪器,检查装置气密性。关闭K1、K2打开K3、K4,点燃酒精灯制备气体。
II.缓慢向C中通入适量气体至C中白磷消失,熄灭酒精灯。
III.关闭K3、K4,打开K1、K2,A中开始发生反应。
IV.C装置控制反应在60℃~65℃,最终制得POCl3产品。
回答下列问题:
(1)B、D装置中盛放的试剂是
(2)仪器a的名称是
(3)步骤IV 控制温度60℃~65℃,其主要目的是
(4)该实验装置存在一处明显的设计缺陷是
(5)通过下面步骤可以测定三氯氧磷产品中Cl 的含量:
I.取xg产品于锥形瓶中,加入足量NaOH 溶液,PCl3完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L 的AgNO3溶液40.00 mL,使Cl-完全沉淀。
III.向其中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
(已知: Ag3PO4溶于酸,Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12)
①滴定选用的指示剂是
a.酚酞 b.淀粉 c.NH4Fe(SO4)2d.甲基橙
②元素Cl的质量分数为(列出算式)
③步骤III若不加入硝基苯,所测Cl含量将会
三氯氧磷(POCl3)可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产业链发展壮大的一种重要的化工原料。工业上可以直接氧化 PCl3 制备 POCl3,反应原理为:P4(白磷)+6Cl2 4PCl3,2PCl3+O2
4PCl3,2PCl3+O2 2POCl3。
2POCl3。
已知:PCl3、POCl3的部分性质如下:
某化学兴趣小组模拟该工艺设计实验装置如图(某些夹持装置和加热装置已略去):
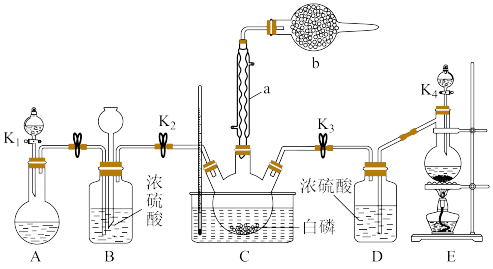
(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器b的名称为___________ ,B装置的作用是___________ 。
(2)装置 E 反应的离子方程式为___________ 。
(3)C反应温度控制 60~65 ℃,不能过高或过低的原因是___________ 。分离提纯获得 POCl3 的实验方法是___________ 。
(4)通过测定三氯氧磷产品中(含PCl3 杂质)氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取a g产品置于盛50.00 mL 蒸馏水的水解瓶中,摇动至完全水解,将水解液配成 100.00 mL 溶液,预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c0 mol/L-1的AgNO3溶液V0 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3)3 指示剂,用c1 mol/L-1 NH4SCN 溶液滴定过量Ag+ 至终点,记下所用体积为V1 mL。
滴定终点的现象:___________ 。实验过程中加入硝基苯覆盖沉淀的目的是___________ ,若无此操作,则所测POCl3的含量将___________ (填“偏高”“偏低”或“不变”)。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12]
(5)产品中POCl3的质量分数为___________ 。
已知:PCl3、POCl3的部分性质如下:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其它 |
| PCl3 | -112 | 75.5 | 137.5 | 遇水生成H3PO3和HCl |
| POCl3 | 2 | 105.3 | 153.5 | 遇水生成H3PO4和HCl |

(1)检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器b的名称为
(2)装置 E 反应的离子方程式为
(3)C反应温度控制 60~65 ℃,不能过高或过低的原因是
(4)通过测定三氯氧磷产品中(含PCl3 杂质)氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取a g产品置于盛50.00 mL 蒸馏水的水解瓶中,摇动至完全水解,将水解液配成 100.00 mL 溶液,预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c0 mol/L-1的AgNO3溶液V0 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3)3 指示剂,用c1 mol/L-1 NH4SCN 溶液滴定过量Ag+ 至终点,记下所用体积为V1 mL。
滴定终点的现象:
(5)产品中POCl3的质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


