解答题-结构与性质 适中0.65 引用2 组卷132
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的电负性由小到大的顺序为________________ 。
(2)C的最高价氧化物分子是________ (填“极性”或“非极性”)分子。
(3)与B同主族元素X,其气态氢化物是同主族元素的氢化物中沸点最高的,解释X的气态氢化物极易溶于水的原因:①_______________ ②_______________
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为____ ;E(CO)5在一定条件下发生分解反应:E(CO)5===E(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是________________ 。
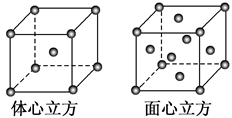
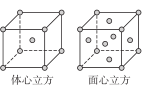
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
体心立方晶胞和面心立方晶胞中E原子的配位数之比为________________ 。
(1)A、B、C、D的电负性由小到大的顺序为
(2)C的最高价氧化物分子是
(3)与B同主族元素X,其气态氢化物是同主族元素的氢化物中沸点最高的,解释X的气态氢化物极易溶于水的原因:①
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
体心立方晶胞和面心立方晶胞中E原子的配位数之比为

17-18高二下·河北唐山·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
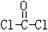 ,分子中C原子的杂化轨道方式是
,分子中C原子的杂化轨道方式是


