解答题-原理综合题 适中0.65 引用1 组卷212
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇。已知: 800℃时
反应①:2H2(g)+CO(g) CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol
反应②:H2(g)+CO2(g) H2O(g)+CO(g) △H=+41.2kJ/mol
H2O(g)+CO(g) △H=+41.2kJ/mol
(1)写出用CO2与H2反应制备甲醇的热化学方程式___________________________________ 。
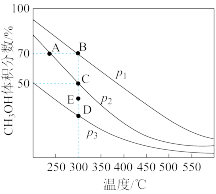
(2)对于反应①,在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1所示。据此判断
①压强P1_____ P2(填“>”“<”或“=”,下同)
②平衡常数K(状态C)_____ K(状态D)
③反应速率:V逆(状态A)_____ V逆(状态B)
(3)对于反应②,在体积一定的密闭容器中加入一定量的H2和CO。进行反应。下列说法正确的是______ 。
A.若该反应在恒容,绝热的容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量,△H的值不发生变化
D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比[n(H2)/n(CO2)]=X,当X=2或1/2时,H2O的体积分数不变。
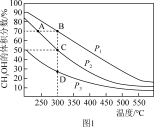
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下图2所示,在0-15h内,对反应催化效果最好的催化剂是____________ (填序号)。
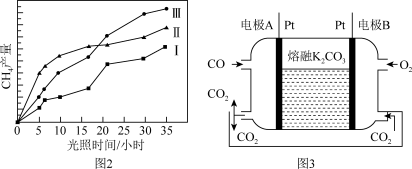
(5)一种新利CO燃料电池工作原理如上图3所示,该电池负极电极反应式为______________ ,电极A处产生的CO2有部分参与循环利用,其利用率为______________________ 。
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇。已知: 800℃时
反应①:2H2(g)+CO(g)
 CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol反应②:H2(g)+CO2(g)
 H2O(g)+CO(g) △H=+41.2kJ/mol
H2O(g)+CO(g) △H=+41.2kJ/mol(1)写出用CO2与H2反应制备甲醇的热化学方程式
(2)对于反应①,在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1所示。据此判断

①压强P1
②平衡常数K(状态C)
③反应速率:V逆(状态A)
(3)对于反应②,在体积一定的密闭容器中加入一定量的H2和CO。进行反应。下列说法正确的是
A.若该反应在恒容,绝热的容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量,△H的值不发生变化
D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比[n(H2)/n(CO2)]=X,当X=2或1/2时,H2O的体积分数不变。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下图2所示,在0-15h内,对反应催化效果最好的催化剂是

(5)一种新利CO燃料电池工作原理如上图3所示,该电池负极电极反应式为
2018·陕西渭南·二模
类题推荐
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH = -49.0kJ·mol-1,
2CH3OH(g) =CH3OCH3(g)+ H2O(g) ΔH =-23.5kJ·mol-1,
则CO2与H2反应合成二甲醚的热化学方程式为__________________________ 。
(2)若反应2CH3OH(g) CH3OCH3(g)+ H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
CH3OCH3(g)+ H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
①写出该反应的平衡常数表达式:K=_______________ 。
②比较该时刻正、逆反应速率的大小:v(正)____ v(逆)(填“>”、“<”或“=”)
③若加入甲醇后经 10 min 反应达到平衡,则平衡后c(CH3OH)=__________ ,该时间内反应速率v(CH3OCH3)=____________ 。
(3)工业上合成甲醇的反应:CO(g)+2H2(g) CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
①下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是________ 。
A. v正(H2)= 2v逆(CH3OH) B. n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2 : 1
C. 混合气体的密度不变 D. 混合气体的平均相对分子质量不变
E. 容器的压强不变
②下列说法正确的是________ 。
A. c1= c2 B. Q1= Q2 C. K1= K2 D. α2+α3 < 100%
③如图表示该反应的反应速率v和时间t的关系图:
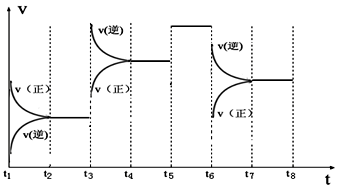
各阶段的平衡常数如下表所示:
K4、K5、K6、K7之间的关系为_________ (填“>”、“<”或“=”)。反应物的转化率最大的一段时间是_________ 。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH = -49.0kJ·mol-1,
2CH3OH(g) =CH3OCH3(g)+ H2O(g) ΔH =-23.5kJ·mol-1,
则CO2与H2反应合成二甲醚的热化学方程式为
(2)若反应2CH3OH(g)
 CH3OCH3(g)+ H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
CH3OCH3(g)+ H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度(mol·L-1) | 0.44 | 0.60 | 0.60 |
②比较该时刻正、逆反应速率的大小:v(正)
③若加入甲醇后经 10 min 反应达到平衡,则平衡后c(CH3OH)=
(3)工业上合成甲醇的反应:CO(g)+2H2(g)
 CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2 mol H2 | 1 mol CH3OH | 2 mol CO、4 mol H2 |
| CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α2 | α3 |
A. v正(H2)= 2v逆(CH3OH) B. n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2 : 1
C. 混合气体的密度不变 D. 混合气体的平均相对分子质量不变
E. 容器的压强不变
②下列说法正确的是
A. c1= c2 B. Q1= Q2 C. K1= K2 D. α2+α3 < 100%
③如图表示该反应的反应速率v和时间t的关系图:

各阶段的平衡常数如下表所示:
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K4 | K5 | K6 | K7 |
I.贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为___________ 。
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为________ kJ/mol。
II.对于反应CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=_____ ,6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为___________ 。
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为 ,则反应的平衡常数K=
,则反应的平衡常数K=______ 。
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。
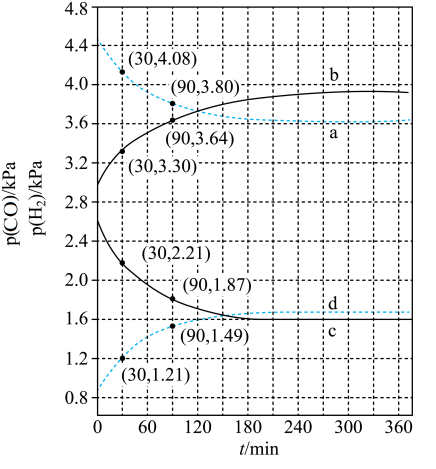
400K时p(H2)随时间变化关系的曲线是______ ,500K时p(CO)随时间变化关系的曲线是_______ 。(填字母序号)
III.在催化剂的作用下发生反应CO(g)+2H2(g) CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g) CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______ υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________ 。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为
II.对于反应CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
| 时间/min | 0 | 2 | 5 | 6 | 9 | 10 |
| x(CO) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。

400K时p(H2)随时间变化关系的曲线是
III.在催化剂的作用下发生反应CO(g)+2H2(g)
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g)
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网