解答题-原理综合题 适中0.65 引用3 组卷367
“低碳经济”正成为科学家研究的主要课题,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0kJ·mol-1
①上述反应中每生成1molFe3O4,转移电子的物质的量为_______ mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=__________ 。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
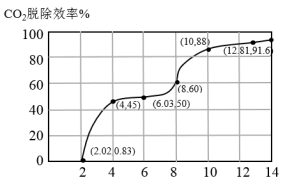
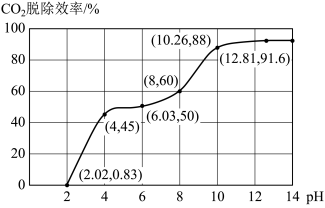
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为____________ (精确到0.01)。
②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是______________ 。
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,回答下列问题:
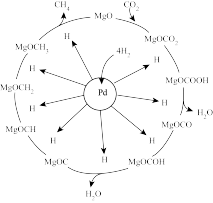
① 该反应的化学方程式为________________ ;反应过程中碳元素的化合价为-2价的中间体是_________ 。
② 向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8mol·L-1、CH4:0.8mol·L-1、H2O:1.6mol·L-1,CO2的平衡转化率为_________________ ;300℃时上述反应的平衡常数K=___________________ 。
③已知该反应正反应放热,现有两个相同恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是________ (填字母):
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0kJ·mol-1
①上述反应中每生成1molFe3O4,转移电子的物质的量为
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为

②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,回答下列问题:

① 该反应的化学方程式为
② 向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8mol·L-1、CH4:0.8mol·L-1、H2O:1.6mol·L-1,CO2的平衡转化率为
③已知该反应正反应放热,现有两个相同恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1。
2018·河南·一模
类题推荐
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6 FeO(s) + CO2(g) = 2 Fe3O4(s) + C(s) ΔH=-76.0 kJ/mol,该反应中每放出38 kJ热量,转移电子的物质的量为_________ mol。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g)ΔH<0
CH4(g)+2H2O(g)ΔH<0
①向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol/L,H2 0.8 mol/L, CH4 0.8 mol/L,H2O 1.6 mol/L,起始充CO2和H2的物质的量分别为___________ 、__________ ,CO2的平衡转化率为___________ 。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充入1 mol CO2和4 mol H2,在II中充入1 mol CH4和2 mol H2O(g),300℃下开始反应。达到平衡时,下列说法正确的是___________ 。

(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6 FeO(s) + CO2(g) = 2 Fe3O4(s) + C(s) ΔH=-76.0 kJ/mol,该反应中每放出38 kJ热量,转移电子的物质的量为
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)
①向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol/L,H2 0.8 mol/L, CH4 0.8 mol/L,H2O 1.6 mol/L,起始充CO2和H2的物质的量分别为
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充入1 mol CO2和4 mol H2,在II中充入1 mol CH4和2 mol H2O(g),300℃下开始反应。达到平衡时,下列说法正确的是
| A.容器I、II中正反应速率相同 |
| B.容器I、II中CH4的物质的量分数相同 |
| C.容器I中CO2的物质的量比容器II中的多 |
| D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1 |

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网