解答题-结构与性质 较难0.4 引用1 组卷409
已知N、S、Cl元素可形成多种物质,在工业生产上有着广泛的应用。回答下列问题:
(1)Fe3+可与SCN-形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使铁的剩余价电子压缩配对,则每个配离子中铁的单电子个数为_______ 个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式______ 。N与S是不同族元素,请解释NH3比H2S在水中溶解度大的原因:__________________ 。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__________ 。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__________ 。
(4)已知S4O62-的结构为 ,其中S原子的杂化方式是
,其中S原子的杂化方式是______ 。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________ 。
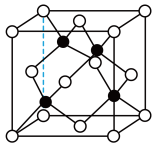
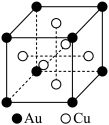
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:

已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为_________ ,晶体的密度为_________ g/cm3(列出计算式,无需化简,设NA为阿伏伽德罗常数的值)。
(1)Fe3+可与SCN-形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使铁的剩余价电子压缩配对,则每个配离子中铁的单电子个数为
(2)Se与S是同族元素,请写出基态Se原子电子排布式
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为
(4)已知S4O62-的结构为
 ,其中S原子的杂化方式是
,其中S原子的杂化方式是(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:

已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为
2018·安徽·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
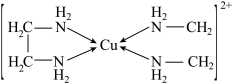 则H、O、N三种元素的电负性从大到小的顺序为
则H、O、N三种元素的电负性从大到小的顺序为