解答题-原理综合题 适中0.65 引用3 组卷147
捕集CO2的技术对解决全球温室效应意义重大。目前国际空间站处理CO2的一个重要方法是将CO2还原,涉及的化学反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g)+Q(Q>0)
CH4(g)+2H2O(g)+Q(Q>0)
完成下列填空:
(1)该反应的平衡常数表达式为________________________________ 。如果改变某种条件,平衡向正反应方向移动,则平衡常数________ (填写编号)。
a、一定增大 b、一定减小 c、可能增大 d、可能减小 e、可能不变
(2)为了提高CO2的捕获百分率,可采取的措施是____________________ 。(任写一条)
(3)向2L某密闭容器充入1mol CO2和4mol H2,一定条件下发生上述反应。5min末测得气体的物质的量减少了20%,则0~5min内CO2的平均反应速率为_______________ 。CO2还可应用于纯碱工业。工业生产纯碱的过程中,向饱和的氨化食盐水中通入足量CO2的生产环节又被称为“碳酸化”。
(4)碳酸化时产生的现象是____________________________ 。碳酸化过程中,溶液中c(CO32-)的变化情况为____________________ 。
(5)碳酸化后过滤,留在滤液中的阳离子主要有_______________ (填写化学式)。简述检验滤液中Cl- 离子的实验操作。________________________________
完成下列填空:
(1)该反应的平衡常数表达式为
a、一定增大 b、一定减小 c、可能增大 d、可能减小 e、可能不变
(2)为了提高CO2的捕获百分率,可采取的措施是
(3)向2L某密闭容器充入1mol CO2和4mol H2,一定条件下发生上述反应。5min末测得气体的物质的量减少了20%,则0~5min内CO2的平均反应速率为
(4)碳酸化时产生的现象是
(5)碳酸化后过滤,留在滤液中的阳离子主要有
2018·上海普陀·二模
类题推荐
氮的单质及其化合物性质多样,用途广泛。完成下列填空:
(1)用催化技术将汽车尾气中的NO和CO转变成CO2和N2,反应原理为:2NO(g)+2CO(g) 2CO2(g)+N2 (g) +Q
2CO2(g)+N2 (g) +Q
某温度下测得该反应在不同时间的CO浓度如下表:
该反应平衡常数K的表达式____________________ ;温度升高,K值___________ (选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=_______________ ;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_________ 。
(2)工业合成氨的反应温度选择500℃左右的主要原因是______________________ 。
(3)在固定容积的密闭容器中,加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是__________________________________________________ 。
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液呈现酸性的原因________________________________ (用离子方程式表示);在通入NH3的过程中溶液的导电能力______ (选填“变大”、“变小”、“几乎不变”)。
(1)用催化技术将汽车尾气中的NO和CO转变成CO2和N2,反应原理为:2NO(g)+2CO(g)
 2CO2(g)+N2 (g) +Q
2CO2(g)+N2 (g) +Q 某温度下测得该反应在不同时间的CO浓度如下表:
| 时间(s) 浓度 ×10-3(mol•L-1) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(CO) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(2)工业合成氨的反应温度选择500℃左右的主要原因是
(3)在固定容积的密闭容器中,加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液呈现酸性的原因
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
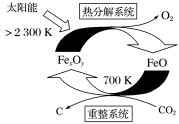
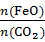 =6,则FexOy的化学式为
=6,则FexOy的化学式为 CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ·mol-1