解答题-工业流程题 适中0.65 引用1 组卷182
聚合硫酸铁(PFS) 是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣 (有效成分为Fe2O3和Fe3O4) 制备PFS,其工艺流程如下图所示。
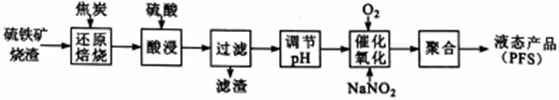
(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为___________________________ 。
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
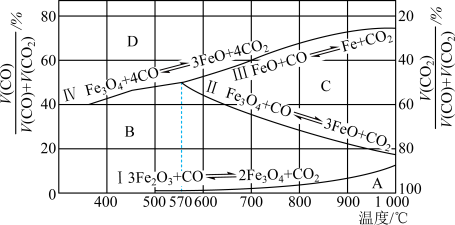
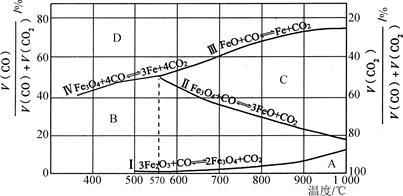
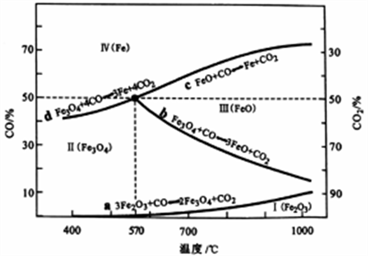
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________ (填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K=_________________ 。
(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是____________________ 。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________ 。
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤_____________ 。
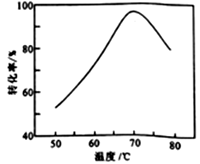
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_________________________ 。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是_______________________________ 。

(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于

(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为

2018·福建·一模
类题推荐
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
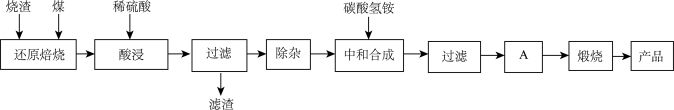
(1)在“还原焙烧”中产生的有毒气体可能有_______________ 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示:_____________________________ 。
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于__ ,当pH=5时,溶液中c(Al3+)为_____ mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为_____________________________________________ 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是_______ 。
(5)A的操作是____________________ 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于___________ (用含m、n的表达式表示)。

(1)在“还原焙烧”中产生的有毒气体可能有
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示:
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是
(5)A的操作是
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网