填空题 适中0.65 引用1 组卷1116
Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为________ ;
②一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
2H2O(g)=2H2(g)+O2(g) ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)=
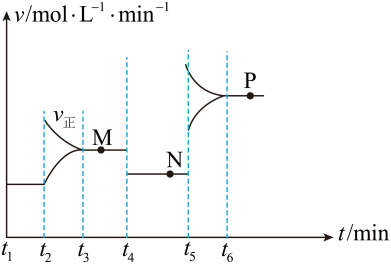
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)=_________________ ;该温度下,反应的平衡常数表达式K=_________________ ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为______ ,t2时改变的条件可能为______________ ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为________________ ;
(2)已知: ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1
 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式________ ;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为________ 。
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为

②一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
2H2O(g)=2H2(g)+O2(g)
(2)已知:
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为
2011·江西赣州·一模
类题推荐
纳米级 Cu2O 由于具有优良的催化性能而受到关注,下表为制取 Cu2O 的三种方法:
(1)已知:2Cu(s)+ O2(g)=Cu2O(s) ΔH=-a kJ·mol-1
O2(g)=Cu2O(s) ΔH=-a kJ·mol-1
C(s)+ O2(g)=CO(g) ΔH=-b kJ·mol-1
O2(g)=CO(g) ΔH=-b kJ·mol-1
Cu(s)+ O2(g)=CuO(s) ΔH=-c kJ·mol-1
O2(g)=CuO(s) ΔH=-c kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=___________ kJ·mol-1。
(2)工业上很少用方法Ⅰ制取 Cu2O,是由于方法Ⅰ反应条件不易控制,若控温不当,会降低 Cu2O产率,请分析原因:______ 。
(3)方法Ⅱ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级 Cu2O,同时放出N2,该制法的化学方程式为_____ 。
(4)方法Ⅲ采用离子交换膜控制电解液中_____ 的浓度而制备纳米 Cu2O,装置如图所示,则阳极上的电极反应式为____ ,当生成1 molCu2O时,就会有_____ NA个阴离子通过离子交换膜。

(5)在2L的密闭容器中,用以上两种方法制得的 Cu2O 分别进行催化分解水的实验:2H2O(g) 2H2(g)+O2(g) ΔH>0,水蒸气的浓度(mol·L-1)随时间 t(min) 变化如下表所示。
2H2(g)+O2(g) ΔH>0,水蒸气的浓度(mol·L-1)随时间 t(min) 变化如下表所示。
①实验时的温度:T2___________ T1。
②方法Ⅰ前20 min 的平均反应速率 v(O2)___________ mol·L-1·min-1。
③方法Ⅲ的平衡常数为___________ 。
方法Ⅰ | 用炭粉在高温条件下还原 CuO |
方法Ⅱ | 用肼(N2H4)还原新制 Cu(OH)2 |
方法Ⅲ | 电解法,反应为 2Cu+H2O |
(1)已知:2Cu(s)+
C(s)+
Cu(s)+
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=
(2)工业上很少用方法Ⅰ制取 Cu2O,是由于方法Ⅰ反应条件不易控制,若控温不当,会降低 Cu2O产率,请分析原因:
(3)方法Ⅱ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级 Cu2O,同时放出N2,该制法的化学方程式为
(4)方法Ⅲ采用离子交换膜控制电解液中

(5)在2L的密闭容器中,用以上两种方法制得的 Cu2O 分别进行催化分解水的实验:2H2O(g)
a gCu2O | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
方法Ⅰ | T1 | 0.050 | 0.049 2 | 0.048 6 | 0.048 2 | 0.048 0 | 0.048 0 |
方法Ⅱ | T1 | 0.050 | 0.048 8 | 0.048 4 | 0.048 0 | 0.048 0 | 0.048 0 |
方法Ⅲ | T2 | 0.10 | 0.088 | 0.080 | 0.080 | 0.080 | 0.080 |
①实验时的温度:T2
②方法Ⅰ前20 min 的平均反应速率 v(O2)
③方法Ⅲ的平衡常数为
碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容。
(1)已知热化学方程式:
①2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH1
②C(s)+O2(g)===CO2(g) ΔH2
③H2(g)+1/2O2(g)===H2O(l) ΔH3
则反应④2C(s)+H2(g)===C2H2(g)的ΔH=_________ 。(用含ΔH1、ΔH2、ΔH3的关系式表示)
(2)利用上述反应①设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池的负极反应式:___________ 。
(3)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) ΔH<0。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH<0。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①1~10 min内,NO的平均反应速率v(NO)=______ ,T1℃时,该反应的平衡常数K1=________ 。T2温度下的平衡常数为K2,若T1>T2,则K1_____ K2
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________ (填字母编号)。
a.通入一定量的NO
b.加入一定量的C
c.适当升高反应体系的温度
d.加入合适的催化剂
e.适当缩小容器的体积
(1)已知热化学方程式:
①2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH1
②C(s)+O2(g)===CO2(g) ΔH2
③H2(g)+1/2O2(g)===H2O(l) ΔH3
则反应④2C(s)+H2(g)===C2H2(g)的ΔH=
(2)利用上述反应①设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池的负极反应式:
(3)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g) ΔH<0。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH<0。在T1℃时,反应进行到不同时间测得各物质的浓度如下:| 时间/min 浓度/(mol·L-1) 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①1~10 min内,NO的平均反应速率v(NO)=
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
a.通入一定量的NO
b.加入一定量的C
c.适当升高反应体系的温度
d.加入合适的催化剂
e.适当缩小容器的体积
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网