解答题-原理综合题 适中0.65 引用2 组卷403
研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)⇌2NO(g) ΔH=+180 kJ·mol−1,2CO(g)+O2(g)⇌2CO2(g) ΔH=-564 kJ·mol−1。
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=
2CO2(g)+N2(g) ΔH=________________ ,该反应在________ 下能自发进行(填“高温”“低温”或“任意温度”)。
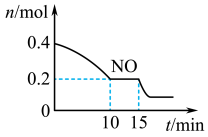
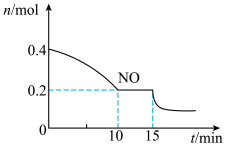
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T ℃时该反应的压力平衡常数Kp=________________ ;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3 mol,平衡将________ (填“向左”“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是___ (填字母)。
A. 增大CO浓度 B. 升温 C. 减小容器体积 D. 加入催化剂
Ⅱ.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10−2 Ka2=6.0×10−7。
(3)请通过计算证明,NaHSO3溶液显酸性的原因:____________________________________ 。
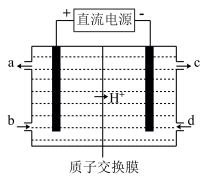
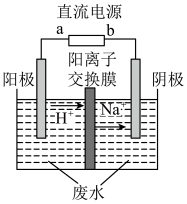
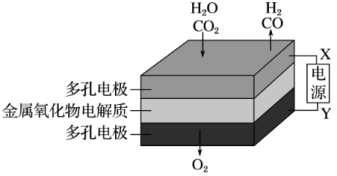
(4)如上方图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为________________________________________ ;若通入的NO体积为4.48 L(标况下),则另外一个电极通入的SO2质量至少为________ g。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)⇌2NO(g) ΔH=+180 kJ·mol−1,2CO(g)+O2(g)⇌2CO2(g) ΔH=-564 kJ·mol−1。
(1)2NO(g)+2CO(g)
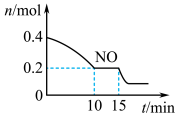
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T ℃时该反应的压力平衡常数Kp=
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是
A. 增大CO浓度 B. 升温 C. 减小容器体积 D. 加入催化剂
Ⅱ.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10−2 Ka2=6.0×10−7。
(3)请通过计算证明,NaHSO3溶液显酸性的原因:
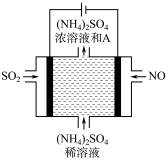
(4)如上方图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为
2018·江西·一模
类题推荐
研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) 2NO(g) ΔH=+196 kJ·mol-1
2NO(g) ΔH=+196 kJ·mol-1
2CO(g)+O2(g) 2CO2(g) ΔH=-554 kJ·mol-1
2CO2(g) ΔH=-554 kJ·mol-1
(1)请写出NO和CO转变为两种无毒无害的物质的热化学方程式_______________ 。
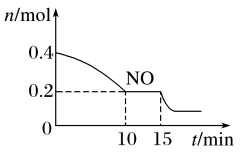
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO物质的量随时间变化如图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=30MPa,则T℃时该反应的压力平衡常数Kp=_______ ;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____ (填序号)
A.升温B.增大CO浓度C.加入催化剂D.减小容器体积
(3)在373K时,向体积为2L的恒容真空容器中通入0.40molNO2,发生反应:2NO2(g) N2O4(g) ΔH=−57.0kJ·mol−1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=−57.0kJ·mol−1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
①0~20min内,v(N2O4)=_________________ 。
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为__________ 。
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为2 CH3CHO+H2O CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为4OH--4e-=O2↑+2H2O、__________________ 。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇_______ kg(计算结果保留2位小数)。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)
2CO(g)+O2(g)
(1)请写出NO和CO转变为两种无毒无害的物质的热化学方程式
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO物质的量随时间变化如图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=30MPa,则T℃时该反应的压力平衡常数Kp=

②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是
A.升温B.增大CO浓度C.加入催化剂D.减小容器体积
(3)在373K时,向体积为2L的恒容真空容器中通入0.40molNO2,发生反应:2NO2(g)
| t/min | 0 | 20 | 40 | 60 | 80 |
| φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20min内,v(N2O4)=
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为2 CH3CHO+H2O

①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为4OH--4e-=O2↑+2H2O、
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
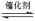 N2(g)+2CO2(g)ΔH<0
N2(g)+2CO2(g)ΔH<0