解答题-原理综合题 较难0.4 引用1 组卷319
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。Na2CO3俗称纯碱,已知25℃时,CO32-第一步水解的平衡常数Kh=2×10-4mol/L,当溶液中c(HCO3-):c(CO32-)=20∶ 1 时,溶液的pH=______ 。
(2)为了除去银器表面Ag2S,可采用如下方法:在一个铝制的容器中放入食盐溶液,将银器浸入食盐溶液,使银器与铝接触良好形成原电池.过一段时间,银器表面变为银白色,并闻到臭鸡蛋的气味,观察到有少量白色絮状沉淀生成,则原电池的正极反应为______________________________ ,请解释臭鸡蛋气味形成的原因(用离子方程式表示)________________________________________ 。
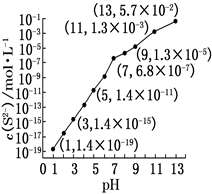
(3)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=11时,溶液中的c(H2S)+c(HS-)=________ mol·L-1。
②某溶液含0.040 mol·L-1M2+、0.10 mol·L-1H2S,当溶液pH=________ 时,Mn2+开始沉淀。[已知:Ksp(MS)=5.6×10-17]
(4)Na2S2O3溶液常作为标准液测定物质的组成。
I.取3.92 g某铁的氧化物,溶于足量稀硫酸,并配制成100.0 mL溶液;
II.取10.00 mL所得溶液,加入足量KI溶液,滴加几滴指示剂;
III.用0.2000 mol • L-1的Na2S2O3标准溶液滴定,重复2~3次,平均消耗标准液20.00mL。
已知:I2+2S2O32-= S4O62-+2I-。则:
①步骤II 所用指示剂的名称为____________ ;判断达到滴定终点的操作和现象___________________ 。
②该铁的氧化物的化学式为______________ 。
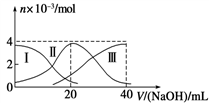
(5)常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如上图,其中三条线代表的是A2-、H2A和HA-浓度变化的曲线,根据图示,当V(NaOH)=20 mL时,溶液中Na+、HA-、 A2-、 H2A四种微粒浓度大小关系:__________________________________ 。溶液显_______ 性。
(2)为了除去银器表面Ag2S,可采用如下方法:在一个铝制的容器中放入食盐溶液,将银器浸入食盐溶液,使银器与铝接触良好形成原电池.过一段时间,银器表面变为银白色,并闻到臭鸡蛋的气味,观察到有少量白色絮状沉淀生成,则原电池的正极反应为
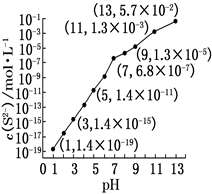
(3)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=11时,溶液中的c(H2S)+c(HS-)=
②某溶液含0.040 mol·L-1M2+、0.10 mol·L-1H2S,当溶液pH=
(4)Na2S2O3溶液常作为标准液测定物质的组成。
I.取3.92 g某铁的氧化物,溶于足量稀硫酸,并配制成100.0 mL溶液;
II.取10.00 mL所得溶液,加入足量KI溶液,滴加几滴指示剂;
III.用0.2000 mol • L-1的Na2S2O3标准溶液滴定,重复2~3次,平均消耗标准液20.00mL。
已知:I2+2S2O32-= S4O62-+2I-。则:
①步骤II 所用指示剂的名称为
②该铁的氧化物的化学式为
(5)常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如上图,其中三条线代表的是A2-、H2A和HA-浓度变化的曲线,根据图示,当V(NaOH)=20 mL时,溶液中Na+、HA-、 A2-、 H2A四种微粒浓度大小关系:

2018·安徽合肥·一模
类题推荐
某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。
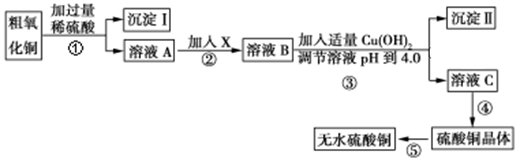
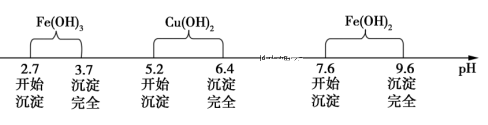
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
(1)已知25℃时,Cu (OH)2的Ksp=4.0×10-20调节溶液pH到4.0时,溶液C中Cu2+的最大浓度为____________ mol·L−1。
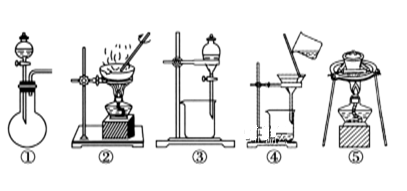
(2)在整个实验过程中,下列实验装置不可能用到的是________ (填序号)。
(3)溶液A中所含溶质为__________________________ ;物质X应选用________ (填序号)。
A.氯水 B.双氧水 C.铁粉 D.高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为______________________________ 。
(5)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
①CuSO4溶液与KI反应的离子方程式为______________________________ 。
②滴定终点的现象是____________________________________________________________ 。
③溶液A中c(Cu2+)=________ mol·L-1。
(6)利用氧化铜和无水硫酸铜按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体且该液体有刺激性气味,则X气体是___________ (填序号),写出其在a处所发生的化学反应方程式___________________________________________ 。

A.H2
B.CH3CH2OH(气)
C.N2

已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:

请回答下列问题:
(1)已知25℃时,Cu (OH)2的Ksp=4.0×10-20调节溶液pH到4.0时,溶液C中Cu2+的最大浓度为
(2)在整个实验过程中,下列实验装置不可能用到的是

(3)溶液A中所含溶质为
A.氯水 B.双氧水 C.铁粉 D.高锰酸钾
(4)从溶液C中制取硫酸铜晶体的实验操作为
(5)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:
(已知:I2+2S2O32-===2I-+S4O62-)
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
②滴定终点的现象是
③溶液A中c(Cu2+)=
(6)利用氧化铜和无水硫酸铜按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体且该液体有刺激性气味,则X气体是

A.H2
B.CH3CH2OH(气)
C.N2
I. H2A在水中存在以下平衡:H2A  H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为__________________ 。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是______________ 。
Ⅱ.含有Cr2O72- 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O72-。为使废水能达标排放,作如下处理:

(3)该废水中加入FeSO4•7H2O和稀硫酸,发生反应的离子方程式为:_______________ 。
(4)欲使25 L该废水中Cr2O72- 转化为Cr3+,理论上需要加入_________ g FeSO4•7H2O。
(5)若处理后的废水中残留的 c(Fe3+)=1×10-13mol/L ,则残留的 Cr3+的浓度为_________ 。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L ,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
III.已知:I2+2S2O32-==2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
(6)步骤c中判断恰好反应完全的现象为
(7)根据以上实验和包装袋说明,所测精制盐的碘含量是__________ mg/kg。(以含w的代数式表示)
 H++HA-,HA-
H++HA-,HA- H++A2-
H++A2-(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是
| A.c(Na+ )>c(K+ ) | B.c(H +)•c(OH )=1×10-14 |
| C.c(Na+ )=c(K+ ) | D.c(Na+ )+c(K+ )=c(HA- )+c(A2-) |
Ⅱ.含有Cr2O72- 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L Cr2O72-。为使废水能达标排放,作如下处理:

(3)该废水中加入FeSO4•7H2O和稀硫酸,发生反应的离子方程式为:
(4)欲使25 L该废水中Cr2O72- 转化为Cr3+,理论上需要加入
(5)若处理后的废水中残留的 c(Fe3+)=1×10-13mol/L ,则残留的 Cr3+的浓度为
III.已知:I2+2S2O32-==2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
(6)步骤c中判断恰好反应完全的现象为
(7)根据以上实验和包装袋说明,所测精制盐的碘含量是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


