解答题-实验探究题 较难0.4 引用1 组卷267
某学习小组开展下列实验探究活动:
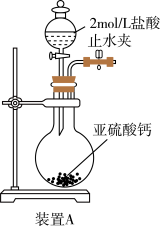
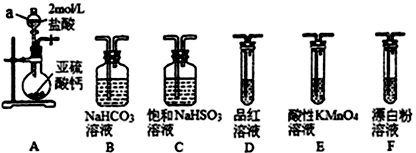
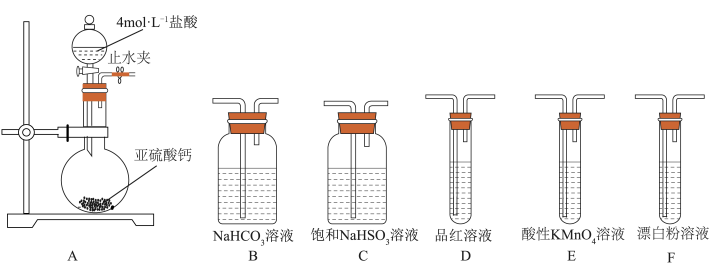
(1)装置A 中反应的化学方程式为___________________________ 。
(2)利用装置A 中产生的气体设计实验证明+4价硫具有氧化性:___________________________ 。
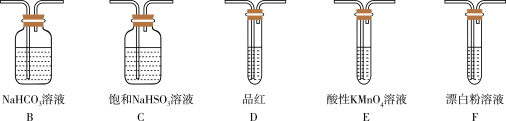
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱。
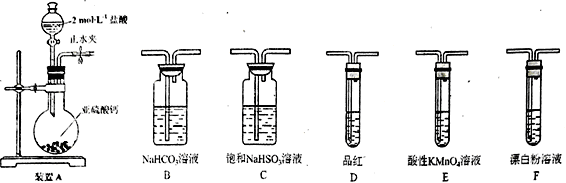
装置连接顺序为___________________________ 。通过___________________________ 现象即可证明亚硫酸的酸性强于次氯酸。
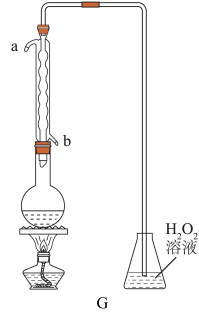
(4)利用G装置可测定装置A 液中SO2的含量。量取1.00 mL残液于烧瓶中,加适量的水稀释,加热使SO2全部逸出并与锥形瓶中H2O2完全反应(SO2+H2O2==H2SO4,然后用0.1000 mol/LNaOH 标准溶液进行滴定,至终点时消耗NaOH溶液20.00mL。
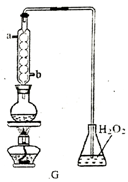
①残液中SO2含量为____________ g·L-1
②经多次测定发现,测定值始终高于实验值,则其原因是___________________________ 。
(5)设计实验证明H2SO3为二元弱酸:___________________________ 。(可提供的仪器:pH计,其他中学化学常见仪器任选,药品:0.10mol·L-1NaOH溶液、0.05 mol·L-1H2SO3溶液,酸碱指示剂)
(1)装置A 中反应的化学方程式为
(2)利用装置A 中产生的气体设计实验证明+4价硫具有氧化性:
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱。

装置连接顺序为
(4)利用G装置可测定装置A 液中SO2的含量。量取1.00 mL残液于烧瓶中,加适量的水稀释,加热使SO2全部逸出并与锥形瓶中H2O2完全反应(SO2+H2O2==H2SO4,然后用0.1000 mol/LNaOH 标准溶液进行滴定,至终点时消耗NaOH溶液20.00mL。

①残液中SO2含量为
②经多次测定发现,测定值始终高于实验值,则其原因是
(5)设计实验证明H2SO3为二元弱酸:
17-18高三·江西宜春·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网