解答题-实验探究题 适中0.65 引用1 组卷691
已知硝酸铜溶液颜色为蓝色。某学校化学课外小组同学们在做铜与浓硝酸、稀硝酸反应的实验中,发现铜和浓硝酸反应后溶液为绿色旦有红棕色气体产生,而铜和稀硝酸反应后溶液为蓝色,产生无色气体。为弄清反应后溶液颜色出现差异的原因,他们进行了实验探究.
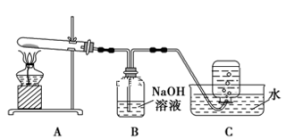
[实验]在两支试管中各放入一小块等质量的铜片,分别加入等体积的浓HNO3(14 mol ∙L-1)和稀HNO3(4mol ∙L-1),立即用蘸有NaOH的棉花封住试管口。充分反应后铜均无剩余。
(1)Cu与浓HNO3反应的离子方程式________________________________
(2)用蘸有NaOH的棉花封住试管口的原因________________
已知NO2与NaOH溶液反应中,其中NO2的还原产物是亚硝酸盐( ),写出反应的化学反应式
),写出反应的化学反应式________________________ ,
[提出假设]假设一、因为铜离子浓度大造成的。
假设二、溶液呈绿色是因为铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
[设计实验方案,验证假设]
(3)上述实验________ (“能”或“不能”)证明假设一不成立,原因________________
(4)甲同学设计实验验证假设二,请帮他完成下表中内容(提示: 在不同条件下的还原产物较复杂,有时难以观察到气体产生)
在不同条件下的还原产物较复杂,有时难以观察到气体产生)
[分析推理]
(5)铜和稀硝酸反应后溶液为蓝色的原理________________
[实验]在两支试管中各放入一小块等质量的铜片,分别加入等体积的浓HNO3(14 mol ∙L-1)和稀HNO3(4mol ∙L-1),立即用蘸有NaOH的棉花封住试管口。充分反应后铜均无剩余。
(1)Cu与浓HNO3反应的离子方程式
(2)用蘸有NaOH的棉花封住试管口的原因
已知NO2与NaOH溶液反应中,其中NO2的还原产物是亚硝酸盐(
[提出假设]假设一、因为铜离子浓度大造成的。
假设二、溶液呈绿色是因为铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
[设计实验方案,验证假设]
(3)上述实验
(4)甲同学设计实验验证假设二,请帮他完成下表中内容(提示:
| 实验步骤 | 预期现象和结论 |
| ①取铜与浓硝酸反应所得的绿色溶液于试管中,多次振荡,静置 ②取铜与稀硝酸反应所得的蓝色溶液通NO2气体 ③ | 溶液颜色由绿色转变为深蓝色,证明假设二成立。 蓝色溶液变成绿色,证明假设二成立。 |
(5)铜和稀硝酸反应后溶液为蓝色的原理
2011·安徽合肥·二模
类题推荐
某研究性学习小组在做Cu 和浓HNO3、稀HNO3反应时,发现生成溶液的颜色有差别。Cu和浓HNO3反应后的溶液为鲜艳草绿色,而Cu和稀HNO3反应溶液为蓝色。
(1)写出Cu和浓HNO3反应的化学方程式:______ 。
(2)该研究性小组成员对反应后生成的溶液颜色差别进行了实验探究。
甲同学认为:绿色是硝酸铜溶液浓度较大引起的,即Cu(NO3)2浓溶液显绿色,Cu(NO3)2稀溶液显蓝色。
乙同学认为:绿色是NO2溶于Cu2+溶液引起的。
①甲同学用Cu(NO3)2晶体配制成稀溶液,溶液为浅蓝色,随着Cu(NO3)2固体的加入,最终配成饱和溶液,颜色逐渐变深,但始终是蓝色。该现象可证明甲同学推测______ (填“合理”或“不合理”)。
②乙同学将Cu与浓HNO3反应后的绿色溶液稍微加热,放出大量红棕色气体,溶液变为______ 色,证明乙同学推测可能成立。
③乙同学设计实验进一步探究,向不同浓度的铜盐溶液中通入NO2气体,实验数据和实验现象如下表:
不同浓度铜盐溶液中通入NO2气体的现象
对比实验1和2,或对比实验3和4,可以得到结论______ 。对比铜与浓硝酸的反应,生成的部分NO2 也会溶入溶液,使溶液呈现绿色。说明“反应混合液”呈绿色确实与NO2气体溶解有关。
(3)丙同学查阅文献:浓硝酸和铜的反应因为有亚硝酸(HNO2)生成,进而可以和Cu2+ 结合成亚硝酸化合物,而铜的亚硝酸化合物是绿色的。
①丙同学设计实验验证生成了亚硝酸(HNO2),取一支试管加入浓硝酸1 mL,插入铜丝后,快速反应,有红棕色气体放出,溶液为绿色;然后加入3滴30%的H2O2溶液,振荡后溶液变为蓝色。分析原因是H2O2和反应过程中生成的HNO2发生了氧化还原反应,写出H2O2和HNO2反应的化学方程式:______ 。
②丙同学继续设计实验验证。取1 mol/LCu(NO3)2溶液2 mL,加入1 mol/L的NaNO2溶液3滴,观察溶液变为绿色,再加入3滴30%H2O2和1滴浓硝酸。溶液很快由绿色变为蓝色。由此可以得到Cu和浓HNO3反应后的溶液为绿色的原因是:______ 。
(1)写出Cu和浓HNO3反应的化学方程式:
(2)该研究性小组成员对反应后生成的溶液颜色差别进行了实验探究。
甲同学认为:绿色是硝酸铜溶液浓度较大引起的,即Cu(NO3)2浓溶液显绿色,Cu(NO3)2稀溶液显蓝色。
乙同学认为:绿色是NO2溶于Cu2+溶液引起的。
①甲同学用Cu(NO3)2晶体配制成稀溶液,溶液为浅蓝色,随着Cu(NO3)2固体的加入,最终配成饱和溶液,颜色逐渐变深,但始终是蓝色。该现象可证明甲同学推测
②乙同学将Cu与浓HNO3反应后的绿色溶液稍微加热,放出大量红棕色气体,溶液变为
③乙同学设计实验进一步探究,向不同浓度的铜盐溶液中通入NO2气体,实验数据和实验现象如下表:
不同浓度铜盐溶液中通入NO2气体的现象
| 实验编号 | ① | ② | ③ | ④ |
| 饱和Cu(NO3)2溶液体积/mL | 2 | 1 | 0 | 0 |
| 蒸馏水体积/mL | 0 | 1 | 0 | 1 |
| 饱和CuSO4溶液体积/mL | 0 | 0 | 2 | 1 |
| 现象 | 蓝绿色 | 蓝绿色 | 绿色 | 绿色 |
(3)丙同学查阅文献:浓硝酸和铜的反应因为有亚硝酸(HNO2)生成,进而可以和Cu2+ 结合成亚硝酸化合物,而铜的亚硝酸化合物是绿色的。
①丙同学设计实验验证生成了亚硝酸(HNO2),取一支试管加入浓硝酸1 mL,插入铜丝后,快速反应,有红棕色气体放出,溶液为绿色;然后加入3滴30%的H2O2溶液,振荡后溶液变为蓝色。分析原因是H2O2和反应过程中生成的HNO2发生了氧化还原反应,写出H2O2和HNO2反应的化学方程式:
②丙同学继续设计实验验证。取1 mol/LCu(NO3)2溶液2 mL,加入1 mol/L的NaNO2溶液3滴,观察溶液变为绿色,再加入3滴30%H2O2和1滴浓硝酸。溶液很快由绿色变为蓝色。由此可以得到Cu和浓HNO3反应后的溶液为绿色的原因是:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网