解答题-工业流程题 适中0.65 引用1 组卷327
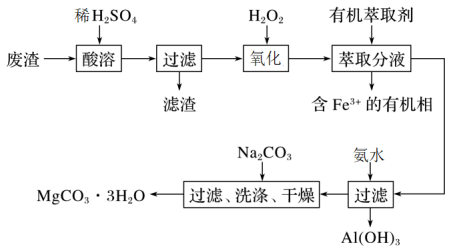
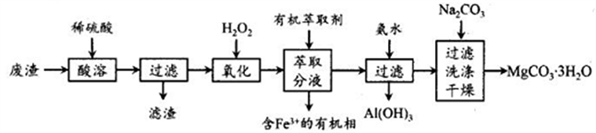
某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:
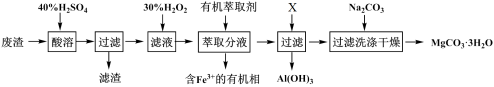
(1)为了加快废渣的酸溶速率,可采取的办法有_________ (任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________ 。
(2)加入30%H2O2的目的是__________________________________ 。
(3)用萃取分液的方法除去溶液中的Fe3+
①加入30%H2O2后,检验溶液中是否含有Fe2+的最佳试剂是__________________________ 。
②萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是______________________________ 。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为__________ ,应调节pH的范围为_________________ 。
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5时,Mg(OH)2开始沉淀
(5)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象是____________________________ 。
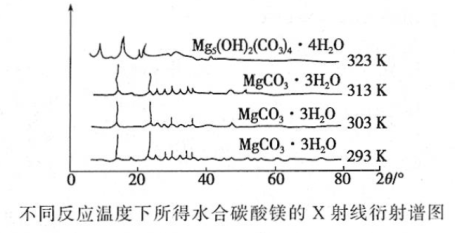
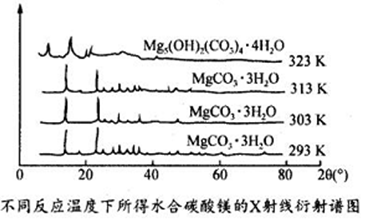
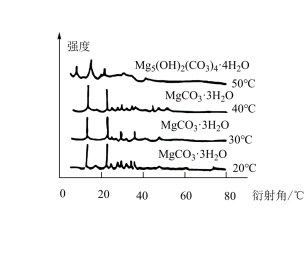
(6)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为___________________ ,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________ 。

(1)为了加快废渣的酸溶速率,可采取的办法有
(2)加入30%H2O2的目的是
(3)用萃取分液的方法除去溶液中的Fe3+
①加入30%H2O2后,检验溶液中是否含有Fe2+的最佳试剂是
②萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5时,Mg(OH)2开始沉淀
(5)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象是
(6)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为

2018·辽宁·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网