解答题-原理综合题 适中0.65 引用1 组卷182
氮气是制备含氮化合物的重要原料,而含氮化合物的用途广泛。回答下列问题:
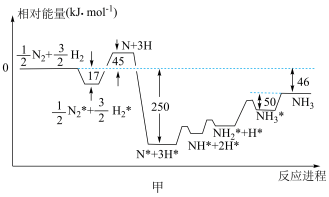
(1)两个常见的固氮反应为:
N2(g)+O2(g) 2NO(g)…………(Ⅰ)
2NO(g)…………(Ⅰ)
N2(g)+3H2(g) 2NH3(g)…………(Ⅱ)
2NH3(g)…………(Ⅱ)
①气相反应中,某物质A 的组成习惯用分压p(A)代替浓度c(A),相应的平衡常数用Kp表示。反应(Ⅰ)的平衡常数表达式Kp=_________________ 。
②反应(Ⅱ)在不同温度下的平衡常数Kp如下表:
则反应(Ⅱ) 的ΔH________ 0(填“>”、“<”或“=”)
(2)合成氨工业中原料气所含的少量CO对合成塔中的催化剂有害,可由“铜洗”工序实现对原料气精制。有关反应的化学方程式如下:
[Cu(NH3)2]Ac(aq)+CO(g) +NH3(g) [Cu(NH3)3] ]Ac·CO(aq)
[Cu(NH3)3] ]Ac·CO(aq)
ΔH=-35 kJ·mol-1,用化学平衡移动原理分析该工序生产的适宜条件为________________________ 。
(3)氨气是工业制硝酸的主要原料。T℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H= -907kJ•mol-1
4NO(g)+6H2O(g) △H= -907kJ•mol-1
②4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H= -1269kJ•mol-1
2N2(g)+6H2O(g) △H= -1269kJ•mol-1
其中②是副反应。若要减少副反应,提高NO的产率,最合理的措施是___________________ ;
T℃时N2和O2反应生成NO的热化学方程式为________________________________ 。
(4)生产和实验中常采用甲醛法测定铵盐的含氢量。反应原理如下:
4NH4++6HCHO==(CH2)6N4H+(一元酸)+3H++6H2O
实验步骤如下:
①取铵盐样品溶液a mL,加入稍过量的甲醛溶液(已除去其中的酸),静置1分钟;
②滴入1-2滴酚酞溶液,用cmol·L-1的氢氧化钠溶液滴定至溶液呈粉红色且半分钟内不褪去为止,记录消耗氢氧化钠溶液的体积;
③重复以上操作2 次,三次实验平均消耗氢氧化钠溶液VmL。
则样品中的含氮量为____ mg·L-1;下列铵盐不适合用甲醛法测定含氮量的是____________ (填标号)。
a.NH4HCO3 b. (NH4)2SO4 c.NH4Cl d.CH3COONH4
(1)两个常见的固氮反应为:
N2(g)+O2(g)
 2NO(g)…………(Ⅰ)
2NO(g)…………(Ⅰ)N2(g)+3H2(g)
 2NH3(g)…………(Ⅱ)
2NH3(g)…………(Ⅱ)①气相反应中,某物质A 的组成习惯用分压p(A)代替浓度c(A),相应的平衡常数用Kp表示。反应(Ⅰ)的平衡常数表达式Kp=
②反应(Ⅱ)在不同温度下的平衡常数Kp如下表:
| 温度/K | 298 | 473 | 673 |
| Kp | 62(KPa)-2 | 6.2×10-5(KPa)-2 | 6.0×10-8(KPa)-2 |
则反应(Ⅱ) 的ΔH
(2)合成氨工业中原料气所含的少量CO对合成塔中的催化剂有害,可由“铜洗”工序实现对原料气精制。有关反应的化学方程式如下:
[Cu(NH3)2]Ac(aq)+CO(g) +NH3(g)
 [Cu(NH3)3] ]Ac·CO(aq)
[Cu(NH3)3] ]Ac·CO(aq)ΔH=-35 kJ·mol-1,用化学平衡移动原理分析该工序生产的适宜条件为
(3)氨气是工业制硝酸的主要原料。T℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H= -907kJ•mol-1
4NO(g)+6H2O(g) △H= -907kJ•mol-1 ②4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H= -1269kJ•mol-1
2N2(g)+6H2O(g) △H= -1269kJ•mol-1其中②是副反应。若要减少副反应,提高NO的产率,最合理的措施是
T℃时N2和O2反应生成NO的热化学方程式为
(4)生产和实验中常采用甲醛法测定铵盐的含氢量。反应原理如下:
4NH4++6HCHO==(CH2)6N4H+(一元酸)+3H++6H2O
实验步骤如下:
①取铵盐样品溶液a mL,加入稍过量的甲醛溶液(已除去其中的酸),静置1分钟;
②滴入1-2滴酚酞溶液,用cmol·L-1的氢氧化钠溶液滴定至溶液呈粉红色且半分钟内不褪去为止,记录消耗氢氧化钠溶液的体积;
③重复以上操作2 次,三次实验平均消耗氢氧化钠溶液VmL。
则样品中的含氮量为
a.NH4HCO3 b. (NH4)2SO4 c.NH4Cl d.CH3COONH4
2018·福建莆田·一模
类题推荐
氮气是制备含氮化合物的重要原料,而含氮化合物的用途广泛。请回答下列问题:
(1)两个常见的固氮反应为:
N2(g)+ O2(g) ⇌2NO(g) (I)
N2(g) + 3H2(g) ⇌2NH3(g) (II)
①气相反应中,物质的组成习惯用分压表示,相应的平衡常数用Kp表示。请写出反应(I)的平衡常数表达式: Kp=___________ 。
②反应(I)、(II)在不同温度下反应的平衡常数Kp示于下表。
根据表中数据判断下列说法中正确的是___________ ( 填序号)。
a.反应(I)为吸热反应,而反应(II)为放热反应
b.常温下,反应(I)的反应速率很小,而反应(II) 的反应速率很大
c.升高温度,反应(I)的反应速率增大,反应(II)的反应速率减小
d.常温下,利用反应(I) 固氮和利用反应(II) 固氮的反应程度相差很大
(2)合成氨工业中原料气的主要成分是N2与H2,但其中所含的少量CO对合成塔的催化剂有害,因此需要对原料气精制,这由“铜洗”工序实现。有关反应的化学方程式如下:
[Cu(NH3)2]Ac (aq)+ CO (g) + NH3(g) ⇌ [Cu(NH3)3]Ac·CO (aq) ΔH = -35 kJ/mol
请分析精炼工序生产条件的控制________ 。实际生产中,必须维持一定的Cu(I)/Cu(II)比例, 为什么________ ?
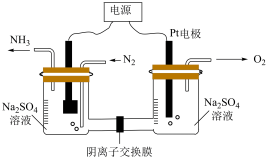
(3)工业上,也可在碱性溶液中通过电解的方法实现由N2制取NH3.通入N2的一极是阴极还是阳极________ ?写出阳极的电极反应方程式________ 。
(4)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。直接供氨碱性燃料电池如图所示。
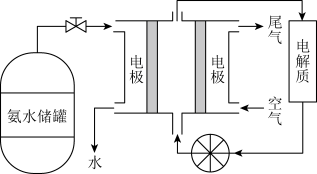
①写出该燃料电池的负极反应方程式_____ 。
②已知一些化学键的键能数据如下表:
请计算反应4NH3(g) + 3O2(g) = 2N2(g) + 6H2O (g)的 ΔH________ 。
(1)两个常见的固氮反应为:
N2(g)+ O2(g) ⇌2NO(g) (I)
N2(g) + 3H2(g) ⇌2NH3(g) (II)
①气相反应中,物质的组成习惯用分压表示,相应的平衡常数用Kp表示。请写出反应(I)的平衡常数表达式: Kp=
②反应(I)、(II)在不同温度下反应的平衡常数Kp示于下表。
| 反应 | (I) | (II) | |||
| 温度/K | 298 | 2000 | 298 | 473 | 673 |
| Kp | 4.5 ×10-31 | 3.8 ×10-4 | 62 (kPa) -2 | 6.2 ×10-5 (kPa)-2 | 6.0 ×10-8 (kPa)-2 |
根据表中数据判断下列说法中正确的是
a.反应(I)为吸热反应,而反应(II)为放热反应
b.常温下,反应(I)的反应速率很小,而反应(II) 的反应速率很大
c.升高温度,反应(I)的反应速率增大,反应(II)的反应速率减小
d.常温下,利用反应(I) 固氮和利用反应(II) 固氮的反应程度相差很大
(2)合成氨工业中原料气的主要成分是N2与H2,但其中所含的少量CO对合成塔的催化剂有害,因此需要对原料气精制,这由“铜洗”工序实现。有关反应的化学方程式如下:
[Cu(NH3)2]Ac (aq)+ CO (g) + NH3(g) ⇌ [Cu(NH3)3]Ac·CO (aq) ΔH = -35 kJ/mol
请分析精炼工序生产条件的控制
(3)工业上,也可在碱性溶液中通过电解的方法实现由N2制取NH3.通入N2的一极是阴极还是阳极
(4)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。直接供氨碱性燃料电池如图所示。

①写出该燃料电池的负极反应方程式
②已知一些化学键的键能数据如下表:
| 化学键 | O-O | O=O | N-N | N=N | N | O-H | N-H |
| 键能/(kJ/mol) | 138 | 498 | 159 | 419 | 945 | 465 | 389 |
请计算反应4NH3(g) + 3O2(g) = 2N2(g) + 6H2O (g)的 ΔH
T℃下,向一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO浓度如下表:
(1)则c2合理的数值为___ (填字母)。
A.4.20 B.4.00 C.2.95 D.2.80
(2)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
若a=2,b=1,则c=__ ,达到平衡时实验组Ⅱ中H2O(g)和实验组Ⅲ中CO的转化率的关系为αⅡ(H2O)___ (填“<”“>”或“=”)αⅢ(CO)。
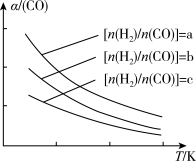
(3)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比 的变化曲线如图所示。
的变化曲线如图所示。
①a、b、c按从大到小的顺序排序为___ 。
②根据图象可以判断该反应为放热反应,理由是___ 。
(4)氨气是工业制硝酸的主要原料。T℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-907kJ·mol-1
4NO(g)+6H2O(g) ΔH=-907kJ·mol-1
②4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH= -1269kJ·mol-1
2N2(g)+6H2O(g) ΔH= -1269kJ·mol-1
其中②是副反应,若要减少副反应,提高NO的产率,最合理的措施是__ ;T℃时N2和O2反应生成NO的热化学方程式为__ 。
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol·L-1 | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol·L-1 | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
(1)则c2合理的数值为
A.4.20 B.4.00 C.2.95 D.2.80
(2)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO | H2 | |||
| Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| Ⅲ | 900 | a | b | c | d | t |

(3)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比①a、b、c按从大到小的顺序排序为
②根据图象可以判断该反应为放热反应,理由是
(4)氨气是工业制硝酸的主要原料。T℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH=-907kJ·mol-1
4NO(g)+6H2O(g) ΔH=-907kJ·mol-1②4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH= -1269kJ·mol-1
2N2(g)+6H2O(g) ΔH= -1269kJ·mol-1其中②是副反应,若要减少副反应,提高NO的产率,最合理的措施是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网