解答题-实验探究题 适中0.65 引用1 组卷320
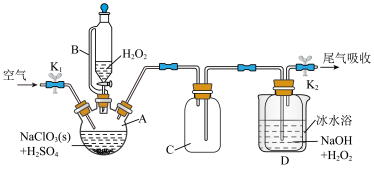
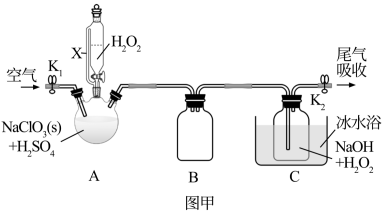
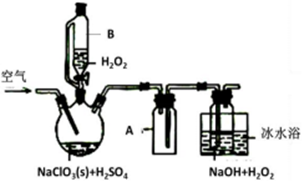
ClO2是一种优良的消毒剂,常将其制成NaClO2 固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:① 2NaClO3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;③H2O2沸点150℃
请回答:
(1)仪器B的作用是__________________ ,仪器A的作用是_________________ ,冰水浴冷却的目的是____________________ (写两种)。
(2)该装置不完善的方面是________________________ 。
(3)空气流速过快或过慢,均降低NaClO产率,试解释其原因________________________ 。
(4)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:①_____________________________ (用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+
(5) NaClO2纯度测定:①准确称取所得 NaClO2样品10.0g 于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________ ,重复滴定3 次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中 NaClO2的质量分数为____________________ 。(M(NaClO2)=90.5g/mol)
已知:① 2NaClO3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;③H2O2沸点150℃

请回答:
(1)仪器B的作用是
(2)该装置不完善的方面是
(3)空气流速过快或过慢,均降低NaClO产率,试解释其原因
(4)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:①
(5) NaClO2纯度测定:①准确称取所得 NaClO2样品10.0g 于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为
2018·广东·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网