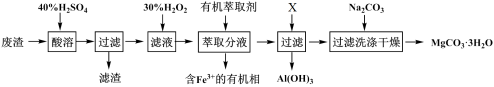
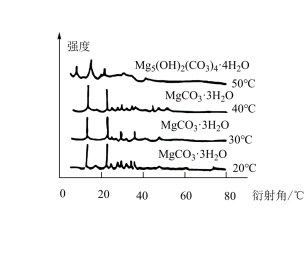
解答题-工业流程题 适中0.65 引用1 组卷339
印刷电路板在科技领域具有不可替代的作用,它的制备方法为高分子化合物和铜箔压合,通过FeCl3溶液“腐蚀”而成。某实验小组在实验室用废弃的印刷电路板和“腐蚀液”提取铜的一种工艺流程如下:
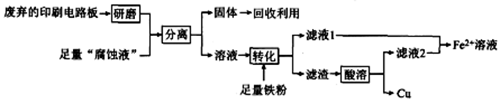
请回答下列问题:
(1)检验“腐蚀液”中含有Fe3+的方法为_____________________________ 。
(2)“分离”所用的操作名称为________ 。该操作所用的主要玻璃仪器除了有烧杯还有_______ 。
(3)Fe2+溶液有很多重要用途。
①已知:常温下Ksp[Fe(OH)2]=1.8×10-16。保存1.8mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊,应调节溶液的pH不超过_______________ 。
②Fe2+转化为Fe3+后,可用于制备高铁酸盐。向FeCl3溶液中加入NaOH、NaClO溶液制备Na2FeO4的化学方程式为____________________________________________ 。
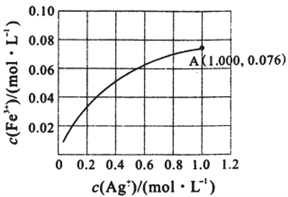
③一定温度下,向0.1 mol•L-1的Fe(NO3)2溶液中加入AgNO3 固体忽略溶液体积的变化,平衡c(Fe3+)与c(Ag+)的关系如图所示:Fe2++Ag+ Fe3++Ag
Fe3++Ag
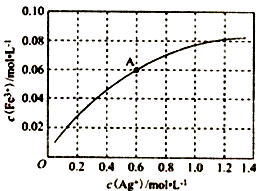
该温度下,A 点溶液中以上反应的化学平衡常数为__________ (溶液体积变化忽略不计);若将0.6 mol•L-1 Fe(NO3)2 溶液、0.15 mol•L-1Fe(NO3)3 溶液、0.06mol•L-1AgNO3溶液等体积混合后,再加入1.08gAg,可观察到的现象为_________________________________ 。

请回答下列问题:
(1)检验“腐蚀液”中含有Fe3+的方法为
(2)“分离”所用的操作名称为
(3)Fe2+溶液有很多重要用途。
①已知:常温下Ksp[Fe(OH)2]=1.8×10-16。保存1.8mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊,应调节溶液的pH不超过
②Fe2+转化为Fe3+后,可用于制备高铁酸盐。向FeCl3溶液中加入NaOH、NaClO溶液制备Na2FeO4的化学方程式为
③一定温度下,向0.1 mol•L-1的Fe(NO3)2溶液中加入AgNO3 固体忽略溶液体积的变化,平衡c(Fe3+)与c(Ag+)的关系如图所示:Fe2++Ag+
 Fe3++Ag
Fe3++Ag
该温度下,A 点溶液中以上反应的化学平衡常数为
18-19高三上·辽宁沈阳·期末
类题推荐
铁元素在溶液中主要以Fe2+、Fe3+、Fe(SCN)3、FeO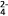 (紫红色)等形式存在。回答下列问题:
(紫红色)等形式存在。回答下列问题:
(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是___________ ,再滴加0.01 mol/L NaOH溶液3 ~5滴,现象是________________________ 。
(2)Fe2+与Ag+在溶液中可相互转化。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如下左图所示:
①用离子方程式表示Fe(NO3)2溶液中的转化反应_________________________________________ 。
②根据A点数据,计算该转化反应的平衡常数为____________________ 。
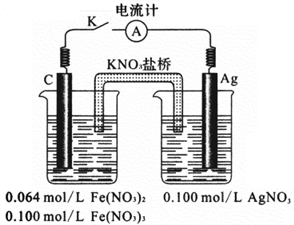
③利用如上右图所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是______ 。石墨为电池的_____ 极,通过列式计算说明原因_______________________________ 。
(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:先加H2O2,目的是_________________________ ,再加碱调节pH为_________ 时,铁刚好沉淀完全;继续加碱至pH为4.5时,铜开始沉淀。
已知:
(4)K2FeO4具有强氧化性。在K2FeO4溶液中加入过量稀硫酸,观察到有无色无味气体产生,还可观察到的现象是_____________________________ ;用K2FeO4处理含NH3废水,既可以把NH3氧化为N2防止水体富营养化,又能生成一种净水剂,该反应的离子方程式为______________________________ 。
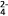 (紫红色)等形式存在。回答下列问题:
(紫红色)等形式存在。回答下列问题:(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是
(2)Fe2+与Ag+在溶液中可相互转化。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如下左图所示:
①用离子方程式表示Fe(NO3)2溶液中的转化反应
②根据A点数据,计算该转化反应的平衡常数为
③利用如上右图所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是
(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:先加H2O2,目的是
已知:
化合物 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-20 | 10-17 | 10-39 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网