解答题-原理综合题 较难0.4 引用1 组卷294
Ⅰ.(1)在2L定容密闭容器中通入1molN2(g)和3molH2(g),发生反应:
3H2(g)+N2(g) 2NH3(g)△H<0,测得压强一时间图象如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图象。
2NH3(g)△H<0,测得压强一时间图象如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图象。
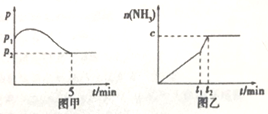
①若图中c=1.6mol,则改变的条件是__________ (填字母,下同);
A.升温 B.降温 C.加压 D.减压 E.加催化剂
②若图中c<1.6mol,则改变的条件是__________ (填字母);此时该反应的平衡常数__________ (填“增大”、“减小”、“不变”)。
(2)如图甲,平衡时氢气的转化率为____________ 。
Ⅱ.粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
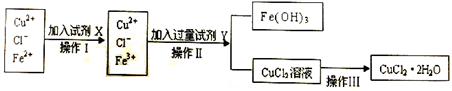
(1)操作Ⅰ时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是__________ 。
A.KMnO4 B.H2O2 C.Cl2 D.HNO3
(2)操作Ⅱ调整溶液的pH的Y试剂可选用下列中的__________ 。
A.NaOH(s) B.氨水 C.CuO(s) D.Cu(OH)2(s)
(3)已知溶度积常数如下表:
将溶液的pH调至pH=4时,使Fe3+完全转化为Fe(OH)3沉淀而除去,此时c(Fe3+)=__________ 。
(4)若将CuCl2溶液蒸干后,再灼烧,得到的固体是__________ (填化学式);操作Ⅲ后由CuCl2·2H2O晶体得到纯净无水CuCl2的合理操作是_____________________________________ 。
3H2(g)+N2(g)
 2NH3(g)△H<0,测得压强一时间图象如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图象。
2NH3(g)△H<0,测得压强一时间图象如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图象。
①若图中c=1.6mol,则改变的条件是
A.升温 B.降温 C.加压 D.减压 E.加催化剂
②若图中c<1.6mol,则改变的条件是
(2)如图甲,平衡时氢气的转化率为
Ⅱ.粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

(1)操作Ⅰ时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是
A.KMnO4 B.H2O2 C.Cl2 D.HNO3
(2)操作Ⅱ调整溶液的pH的Y试剂可选用下列中的
A.NaOH(s) B.氨水 C.CuO(s) D.Cu(OH)2(s)
(3)已知溶度积常数如下表:
| 物质 | Cu(OH) | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
将溶液的pH调至pH=4时,使Fe3+完全转化为Fe(OH)3沉淀而除去,此时c(Fe3+)=
(4)若将CuCl2溶液蒸干后,再灼烧,得到的固体是
17-18高二上·吉林·期末
类题推荐
已知:相关物质的溶度积常数见下表:
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
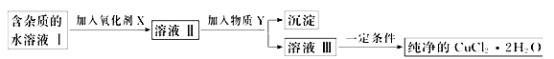
(1)最适合作氧化剂X的是_________ (填字母),加入X的目的是______________ 。
A.K2Cr2O7B.NaClO C.H2O2D.KMnO4
加入的物质Y是____________ (填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=__________ 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(I2+2S2O32-= S4O62-+2I-)
①可选用___________ 作滴定指示剂。
②CuCl2溶液与KI反应的离子方程式为________________ 。
③该试样中CuCl2·2H2O的质量百分数为_______________ 。
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:

(1)最适合作氧化剂X的是
A.K2Cr2O7B.NaClO C.H2O2D.KMnO4
加入的物质Y是
(2)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(I2+2S2O32-= S4O62-+2I-)
①可选用
②CuCl2溶液与KI反应的离子方程式为
③该试样中CuCl2·2H2O的质量百分数为
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
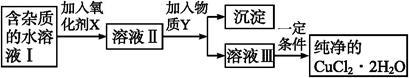
已知某温度下:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
请回答下列问题:
(1)加入氧化剂X的目的是_______________________ 。
(2)最适合作氧化剂X的是___________ (填编号,否则不给分);写出氧化剂X参与的离子反应方程式_________ 。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)为了除去Fe3+,需加入物质Y_________ (填化学式)调节溶液的pH值为___________ 。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________ (填“能”或“不能”);若能,不用回答;若不能,回答该如何操作?____________________ 。
(5)常温下已知Fe(OH)3的Ksp=1.0×10-35,向500mL 0.2mol/L的FeCl3溶液中加入NaOH固体(溶液体积变化忽略不计)后pH=3.0,则需要加入氢氧化钠固体的质量为________ g。

已知某温度下:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
(1)加入氧化剂X的目的是
(2)最适合作氧化剂X的是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)为了除去Fe3+,需加入物质Y
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?
(5)常温下已知Fe(OH)3的Ksp=1.0×10-35,向500mL 0.2mol/L的FeCl3溶液中加入NaOH固体(溶液体积变化忽略不计)后pH=3.0,则需要加入氢氧化钠固体的质量为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网