解答题-实验探究题 较难0.4 引用2 组卷368
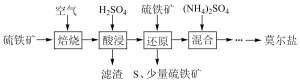
硫酸亚铁铵(NH4)aFeb(SO4)c·dH2O又称莫尔盐,是浅绿色晶体,用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:
FeS2 +14Fe3++8H2O =15Fe2++2SO42-+16H+
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:__________________________ 。实验室检验“还原”已完全的方法是:__________________________ 。
(2)称取11.76g新制莫尔盐,溶于水配成250mL溶液。取25.00mL该溶液加入足量的BaCl2溶液,得到白色沉淀1.398g;另取25.00mL该溶液用0.0200mol/LKMnO4酸性溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗溶液的体积为30.00mL。试确定莫尔盐的化学式(请写出计算过程)_________ 。

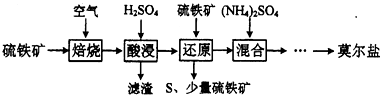
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:
FeS2 +14Fe3++8H2O =15Fe2++2SO42-+16H+
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:
(2)称取11.76g新制莫尔盐,溶于水配成250mL溶液。取25.00mL该溶液加入足量的BaCl2溶液,得到白色沉淀1.398g;另取25.00mL该溶液用0.0200mol/LKMnO4酸性溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗溶液的体积为30.00mL。试确定莫尔盐的化学式(请写出计算过程)
18-19高三上·江苏泰州·阶段练习
类题推荐
硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
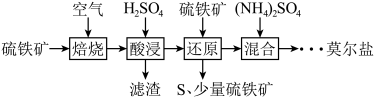
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:FeS2+14Fe3++8H2O 15Fe2++2
15Fe2++2 +16H+
+16H+
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:_____ 。实验室检验“还原”已完全的方法是_____ 。
(2)“还原”前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
请计算反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比_____ 。
(3)硫酸亚铁铵较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.400 g Cu2S和CuS的混合物在酸性溶液中用60.0 mL 0.100 mol·L−1KMnO4溶液处理,发生反应如下:8 +5Cu2S+44H+
+5Cu2S+44H+ 10Cu2++5SO2+8Mn2++22H2O 6
10Cu2++5SO2+8Mn2++22H2O 6 +5CuS+28H+
+5CuS+28H+ 5Cu2++5SO2+6Mn2++14H2O
5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.500 mol·L−1硫酸亚铁铵溶液完全反应。已知: +Fe2++H+
+Fe2++H+ Mn2++Fe3++H2O(未配平),求V的取值范围
Mn2++Fe3++H2O(未配平),求V的取值范围___________ (写出计算过程)。

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:FeS2+14Fe3++8H2O
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:
(2)“还原”前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
| 离子 | 离子浓度(mol·L−1) | |
| 还原前 | 还原后 | |
| 3.20 | 3.40 | |
| Fe2+ | 0.05 | 2.15 |
(3)硫酸亚铁铵较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.400 g Cu2S和CuS的混合物在酸性溶液中用60.0 mL 0.100 mol·L−1KMnO4溶液处理,发生反应如下:8
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.500 mol·L−1硫酸亚铁铵溶液完全反应。已知:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网