解答题-结构与性质 较难0.4 引用1 组卷237
碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为[Ar]______________________ ;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________ (填角度)。
(3)砷化硼(BAs)是ⅢA一VA族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与____________ 个B相连,As的杂化形式为_______________ ;
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有____________ (填字母)。
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________________________________ (填晶体类型)。
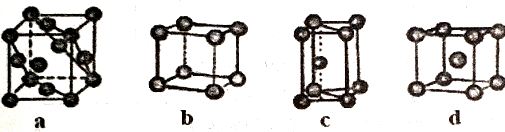
(5)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___________ (填字母)。
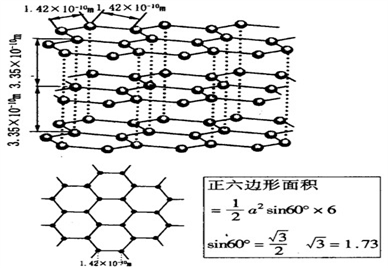
(6)石墨晶体的结构如下图,石墨的密度为________________________________ (只列式不化简不计算)
(1)基态As原子的电子排布式为[Ar]
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是
(3)砷化硼(BAs)是ⅢA一VA族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于
(5)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为

(6)石墨晶体的结构如下图,石墨的密度为

17-18高三·宁夏银川·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网





