填空题 较难0.4 引用2 组卷196
已知氨气在生活、生产、科研中有极广泛用途。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和液态水 的热化学方程式为___________________ ,该反应在_________ 条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________ ;
②计算得到可逆反应AgCl (s)+2NH3(aq) Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________ ;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______ mol(保留2位有效数字)。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)
 Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=②计算得到可逆反应AgCl (s)+2NH3(aq)
 Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=17-18高二上·广东中山·阶段练习
类题推荐
氮及其化合物在生活、生产、科研中有广泛用途。
(1)已知反应 I : 2NH3(g) +CO2(g)=NH2CO2NH4(s)△H=-159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2(s)+ H2O(g) △H=+116.5 kJ/mol
反应Ⅲ:H2O(l) = H2O(g) △H=+44.0 kJ/mol
则工业上以二氧化碳、氨为原料合成化肥尿素和液态水的热化学方程式为________________________ 。
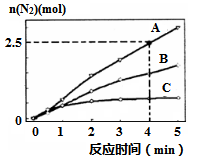
(2)用NH3催化还原NxOy可以消除氮氧化物的污染。如有反应4NH3(g)+6NO(g) 5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
①0~4分钟在A催化剂作用下,反应速率υ(N2)=______ 。
②下列说法不正确的是____________
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内H-O与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、 丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、 丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该反应为_____________________ (填“放热”或“吸热”)反应。
②在上述条件下乙容器达到平衡时,NO的转化率=_____________________ 。
(4)①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=___________________ 。
②查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.76×10-10。
计算得到可逆反应AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_____ (保留4位有效数字)。
(1)已知反应 I : 2NH3(g) +CO2(g)=NH2CO2NH4(s)△H=-159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2(s)+ H2O(g) △H=+116.5 kJ/mol
反应Ⅲ:H2O(l) = H2O(g) △H=+44.0 kJ/mol
则工业上以二氧化碳、氨为原料合成化肥尿素和液态水的热化学方程式为
(2)用NH3催化还原NxOy可以消除氮氧化物的污染。如有反应4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。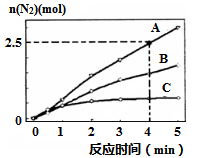
①0~4分钟在A催化剂作用下,反应速率υ(N2)=
②下列说法不正确的是
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内H-O与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)用焦炭还原NO的反应为:2NO(g)+C(s)
 N2(g)+CO2(g),向容积均为1L的甲、乙、 丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、 丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为
②在上述条件下乙容器达到平衡时,NO的转化率=
(4)①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)
 Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+(aq),该反应平衡常数的表达式为K稳=②查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.76×10-10。
计算得到可逆反应AgCl(s)+2NH3(aq)
 Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网