解答题-原理综合题 困难0.15 引用1 组卷612
能源是人类生存与发展必不可缺的物质,对传统能源进行脱硫、脱硝处理,能提高能源在能源消费中的比例是改变目前我国频发的雾霾天气的有效措施。
(1)肼(N2H4)和化合物甲是一种重要的火箭推进剂,甲分子与肼分子具有相同的电子数,二者反应的生成物中有10e-分子,另一种生成物为极稳定的单质,写出该反应的化学方程式__________________ 。
(2)对燃煤产生的尾气进行回收处理,有助于空气质量的改善,还能变废为宝,尾气处理过程中涉及到的主要反应如下:
①2CO(g)+SO2(g)=S(g)+2CO2(g) △H=十8.0 kJ·mol-1
②2H2 (g)+SO2(g)=S(g)+2H2O(g) △H=+90.4 kJ·mol-1
③2CO(g)+O2 (g) =2CO2 (g) △H= -566.0 kJ·mol-1
④2H2 (g)+O2 (g) =2H2O(g) △H =-483.6 kJ·mol-1
S(g)与O2(g)反应生成SO2(g)的热化学方程式为__________________ 。
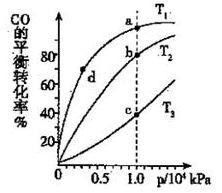
(3)煤炭液化也有助于减少雾霾天气的发生,液化反应之一为:CO(g)+2H2(g) CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为
CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为__________ ;实际生产条件控制在T 1°C、1×106Pa左右,选择此压强的理由是________ 。
(4)工业上生产新能源二甲醚(CH3OCH3)的原理之一为:2CO(g)+6H2(g) CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:
CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:
填写表中空白处,并写出其推测过程___________ 。
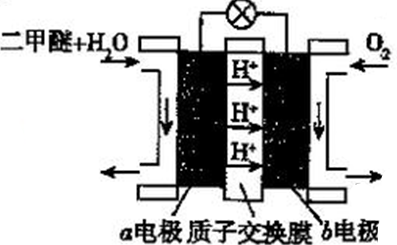
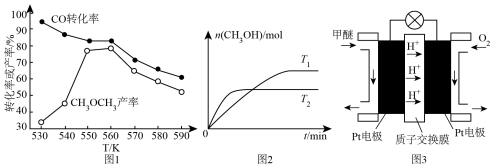
(5)二甲醚(燃烧热为1455kJ/mol)燃料电池是一种绿色电池,其工作原理如图所示,a、b均为惰性电极,a极的电极反应式为________________________ ;当消耗1molO2时,通过质子交换膜的质子数为_________ NA;若电池工作时消耗1mol二甲醚所能产生的最大电能为1320kJ,则该燃料电池的工作效率为________ (燃烧电池的工作效率是指电池所能产生的最大电能与燃料燃烧时所能释放的全部热能之比)。
(1)肼(N2H4)和化合物甲是一种重要的火箭推进剂,甲分子与肼分子具有相同的电子数,二者反应的生成物中有10e-分子,另一种生成物为极稳定的单质,写出该反应的化学方程式
(2)对燃煤产生的尾气进行回收处理,有助于空气质量的改善,还能变废为宝,尾气处理过程中涉及到的主要反应如下:
①2CO(g)+SO2(g)=S(g)+2CO2(g) △H=十8.0 kJ·mol-1
②2H2 (g)+SO2(g)=S(g)+2H2O(g) △H=+90.4 kJ·mol-1
③2CO(g)+O2 (g) =2CO2 (g) △H= -566.0 kJ·mol-1
④2H2 (g)+O2 (g) =2H2O(g) △H =-483.6 kJ·mol-1
S(g)与O2(g)反应生成SO2(g)的热化学方程式为
(3)煤炭液化也有助于减少雾霾天气的发生,液化反应之一为:CO(g)+2H2(g)
 CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为
CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为
(4)工业上生产新能源二甲醚(CH3OCH3)的原理之一为:2CO(g)+6H2(g)
 CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:
CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:容器 | c(CO) | c(H2) | c(CH3OCH3) | c(H2O) | v(正)与v(逆)大小比较 |
I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)= v(逆) |
II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | v(正) |
(5)二甲醚(燃烧热为1455kJ/mol)燃料电池是一种绿色电池,其工作原理如图所示,a、b均为惰性电极,a极的电极反应式为

17-18高二上·福建宁德·期末
类题推荐
2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g)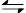 CH3OCH3(g)+3H2O(g) △H>0。
CH3OCH3(g)+3H2O(g) △H>0。
①写出该反应的平衡常数表达式 。
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g)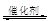 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
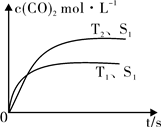
据此判断:
①该反应的ΔH 0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)已知:CO(g)+ 2H2(g) CH3OH(g)△H =" -a" kJ•mol-1。
CH3OH(g)△H =" -a" kJ•mol-1。
①经测定不同温度下该反应的平衡常数如下:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)="0.4" mol·L-1、c(H2)="0.4" mol·L-1、c(CH3OH)="0.8" mol·L-1, 则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
达到平衡时CO的转化率为 。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H>0。
CH3OCH3(g)+3H2O(g) △H>0。①写出该反应的平衡常数表达式 。
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
| A.容器中密度不变 |
| B.单位时间内消耗2molCO2,同时消耗1mol二甲醚 |
| C.v(CO2)︰v(H2)=1︰3 |
| D.容器内压强保持不变 |
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g)
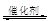 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
据此判断:
①该反应的ΔH 0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)已知:CO(g)+ 2H2(g)
 CH3OH(g)△H =" -a" kJ•mol-1。
CH3OH(g)△H =" -a" kJ•mol-1。①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)="0.4" mol·L-1、c(H2)="0.4" mol·L-1、c(CH3OH)="0.8" mol·L-1, 则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为 。
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2CO(g)+2H2(g) 。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_____P2(填 “大于”或“小于”);压强为P2时,在Y点:v(正)v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K=。(计算结果保留两位有效数字)
2CO(g)+2H2(g) 。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_____P2(填 “大于”或“小于”);压强为P2时,在Y点:v(正)v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K=。(计算结果保留两位有效数字)


