解答题-原理综合题 适中0.65 引用1 组卷161
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________ 。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________ 。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) CH3OCH3(g) + CO2 (g)的ΔH=
CH3OCH3(g) + CO2 (g)的ΔH= ___________ ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________ (填字母代号)
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
① 比较此时正、逆反应速率的大小:v正______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) =_________ ;该时间内反应速率v(CH3OH) = __________ 。达到平衡时甲醇的转化率α(CH3OH)= _________
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)
② 2CH3OH(g)
③ CO(g) + H2O(g)
总反应:3H2(g) + 3CO(g)
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) =
16-17高三·山东泰安·阶段练习
知识点:化学反应原理综合考查化学反应原理综合考查盖斯定律与热化学方程式盖斯定律与热化学方程式化学平衡常数的有关计算化学平衡常数的有关计算转化率的相关计算及判断转化率的相关计算及判断 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______ .
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)⇌CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式______ .
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是______ .
a.高温低压
b.低温高压
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
f.加入催化剂
(4)已知反应②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v正______ v逆(填“>”、“<”或“=”),若上述情况达到平衡,此时c(CH3OH)= ______
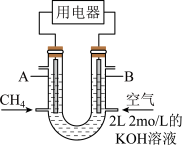
(5)将CH4设计成燃料电池,其装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为______ ;
②44.8L<V≤89.6L时,负极电极反应为______ ;
③V=67.2L时,溶液中阴离子浓度大小关系为______ .

(1)煤的气化的主要化学反应方程式为:
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)⇌CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
a.高温低压
b.低温高压
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
f.加入催化剂
(4)已知反应②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v正
(5)将CH4设计成燃料电池,其装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为
②44.8L<V≤89.6L时,负极电极反应为
③V=67.2L时,溶液中阴离子浓度大小关系为
(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是____ (填字母代号)。
a.升高温度 b.加入催化剂 c.减小CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v(正)____ v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=____ ;该时间内反应速率v(CH3OH)=____ 。
 CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是a.升高温度 b.加入催化剂 c.减小CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


