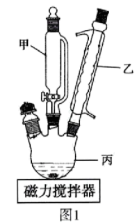
解答题-实验探究题 适中0.65 引用3 组卷125
次氯酸钠稳定性远高于次氯酸钠,也可用于杀菌消毒。制备次氯酸钠方法较多,常用的一种合成路线如下:
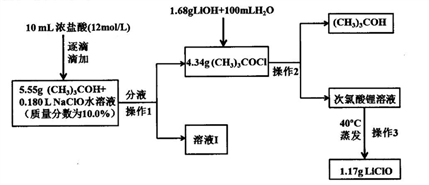
已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),B装置中支管的作用是___________ ;浓盐酸逐滴滴加而不是一次性加入的原因是_______________ 。
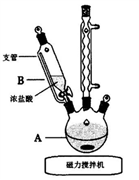
(2)请写出在装置A中发生反应的化学方程式___________________ 。
(3)对于操作1,下列说法不正确的是__________ 。
A.可以选用250mL规格的分液漏斗
B.操作1须在通风橱内进行
C.进行分液时,可提早关闭旋塞,以防止次氯酸叔丁酯从下口流出
D.装置B不合适进行操作1
(4)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因__________ 。
(5)该实验中次氯酸锂的产率为_____________ 。

已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),B装置中支管的作用是

(2)请写出在装置A中发生反应的化学方程式
(3)对于操作1,下列说法不正确的是
A.可以选用250mL规格的分液漏斗
B.操作1须在通风橱内进行
C.进行分液时,可提早关闭旋塞,以防止次氯酸叔丁酯从下口流出
D.装置B不合适进行操作1
(4)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因
(5)该实验中次氯酸锂的产率为
2017·浙江宁波·一模
类题推荐
柠檬酸三正丁酯是微溶于水的无色油状液体,因其无毒、挥发性小的性质可作为环保型增塑剂。实验室制备柠檬酸三正丁酯的原理、装置如下:
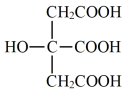 +3CH3CH2CH2CH2OH
+3CH3CH2CH2CH2OH
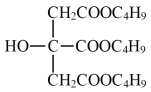 +3H2O
+3H2O
相关反应物及产物的参数如下表:
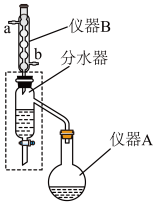
制备和提纯步骤如下:
①将沸石、3mL浓硫酸(a)、19.2 g柠檬酸(b)和45 mL过量的正丁醇(c)按一定顺序加入到仪器A中;
②加热仪器A中反应液至140~150℃,待反应完成后停止加热;
③待仪器A中液体冷却后,用5%的NaOH溶液洗涤并分液;
④有机层通过___________操作回收正丁醇;
⑤粗产品显淡黄色,依次加入无水氯化钙和活性炭并过滤后得到纯度较高的产品22.5 g。
请回答下列问题:
(1)仪器B的名称是___________ ,其作用是___________ 。向仪器A中加入沸石后,三种试剂加入的顺序依次为___________ (用a、b、c表示)。
(2)步骤③中加入5%的NaOH溶液洗涤是为除去___________ 杂质。步骤④中分离正丁醇与柠檬酸三正丁酯的方法是___________ 。
(3)分水器的作用是不断分离出反应生成的水使反应正向进行,同时上层的液体会回流到仪器A中,则步骤②反应完成的标志是___________ 。
(4)该实验中柠檬酸三正丁酯的产率为___________ 。
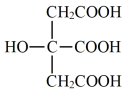 +3CH3CH2CH2CH2OH
+3CH3CH2CH2CH2OH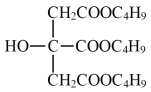 +3H2O
+3H2O相关反应物及产物的参数如下表:
| 物质 | 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 溶解性 |
| 柠檬酸 | 192 | 1.54 | 175(分解) | 易溶于水,易溶于醇等有机溶剂 |
| 正丁醇 | 74 | 0.81 | 118 | 微溶于水 |
| 柠檬酸三正丁酯 | 360 | 1.05 | 225 | 微溶于水,易溶于醇等有机溶剂 |

制备和提纯步骤如下:
①将沸石、3mL浓硫酸(a)、19.2 g柠檬酸(b)和45 mL过量的正丁醇(c)按一定顺序加入到仪器A中;
②加热仪器A中反应液至140~150℃,待反应完成后停止加热;
③待仪器A中液体冷却后,用5%的NaOH溶液洗涤并分液;
④有机层通过___________操作回收正丁醇;
⑤粗产品显淡黄色,依次加入无水氯化钙和活性炭并过滤后得到纯度较高的产品22.5 g。
请回答下列问题:
(1)仪器B的名称是
(2)步骤③中加入5%的NaOH溶液洗涤是为除去
(3)分水器的作用是不断分离出反应生成的水使反应正向进行,同时上层的液体会回流到仪器A中,则步骤②反应完成的标志是
(4)该实验中柠檬酸三正丁酯的产率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网