解答题-原理综合题 适中0.65 引用3 组卷409
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是________ 。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图象回答下列问题。
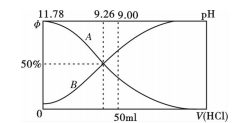
①表示NH3·H2O浓度变化的曲线是__________ (填“A”或“B")。
②NH3·H2O的电离常数为_______ (已知lg1.8 = 0.26)。
③当加入盐酸体积为50ml时,溶液中c(NH4+)- c(NH3·H2O) =_____ mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________ .
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图象回答下列问题。

①表示NH3·H2O浓度变化的曲线是
②NH3·H2O的电离常数为
③当加入盐酸体积为50ml时,溶液中c(NH4+)- c(NH3·H2O) =
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O
 H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。(1)写出液氨的电离方程式
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系
2017·湖北荆州·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网