解答题-实验探究题 较难0.4 引用1 组卷330
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈;二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
I.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤溶液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
已知:20℃时溶解度/g
(1)用NaOH溶解二氧化硅的化学方程式是_________
(2)在步骤Ⅱ中:①加入盐酸可除去CaCO3、Fe2O3和Mg(OH)2.写出盐酸与Mg(OH)2反应的离子方程式:___________ 。
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因_________
(3)步骤Ⅲ中,加入Na2SO3的目的是将步骤Ⅱ中生成的Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉。写出Na2SO3和Fe3+反应的高子方程式___________ 。
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①如果转移的电子有2.4mol,则有________ g铁被钝化。
②钝化效果的检测一般可用滤纸浸渍配好的检测液后贴附于待测样品表面或直接将溶液涂、滴于待测表面。下面检测钝化效果的方法合理的是__________ 。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加浓HNO3观察出现红棕色气体的时间
d.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
I.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤溶液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| l.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
(2)在步骤Ⅱ中:①加入盐酸可除去CaCO3、Fe2O3和Mg(OH)2.写出盐酸与Mg(OH)2反应的离子方程式:
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因
(3)步骤Ⅲ中,加入Na2SO3的目的是将步骤Ⅱ中生成的Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉。写出Na2SO3和Fe3+反应的高子方程式
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①如果转移的电子有2.4mol,则有
②钝化效果的检测一般可用滤纸浸渍配好的检测液后贴附于待测样品表面或直接将溶液涂、滴于待测表面。下面检测钝化效果的方法合理的是
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加浓HNO3观察出现红棕色气体的时间
d.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
17-18高三上·山西·阶段练习
类题推荐
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。 水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是_________________________ 。
(2)已知:20℃时溶解度/g
则步骤Ⅰ中加入Na2CO3可除去水垢中的______________________ 。
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有____________________________ 。
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因__________________ 。
(4)步骤Ⅲ中,加入Na2SO3的目的是______________________ 。(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①完成并配平其反应的离子方程式:
____ Fe+____NO2-+____H2O=______N2↑+__________+_______。
②如果有16.8 g铁被钝化,则转移的电子数为___________________ (保留三位有效数字)。
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是
(2)已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
则步骤Ⅰ中加入Na2CO3可除去水垢中的
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因
(4)步骤Ⅲ中,加入Na2SO3的目的是
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①完成并配平其反应的离子方程式:
②如果有16.8 g铁被钝化,则转移的电子数为
(1)已知Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。常温下,某酸性CuCl2溶液中含有少量的FeCl3,为了得到纯净的CuCl2·2H2O晶体,应加入___________ (填氧化物的化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________ 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗涤液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
①用稀盐酸溶解碳酸钙的离子方程式是_____________________________ 。
②已知:25 ℃时有关物质的溶度积
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________ 。(用溶解平衡表达式和必要的文字叙述加以说明);在步骤Ⅰ浸泡过程中还会发生反应MgCO3(s)+2OH-(aq) Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=
Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________ (保留两位有效数字)。
③步骤Ⅲ中,加入Na2SO3溶液的目的是_______________________________ 。
(2)某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗涤液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
①用稀盐酸溶解碳酸钙的离子方程式是
②已知:25 ℃时有关物质的溶度积
| 物质 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| Ksp | 2.8×10-9 | 9.1×10-6 | 1.8×10-11 | 6.8×10-6 |
 Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=
Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=③步骤Ⅲ中,加入Na2SO3溶液的目的是
工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:
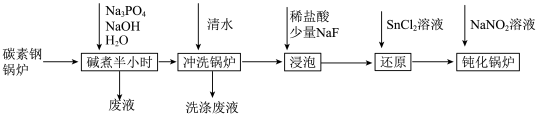
已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________ 。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________ ;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________ 。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________ ;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________ (填现象),则保护膜致密性欠佳。
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________ 。

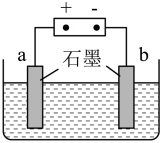
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________ 。

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
| 难溶物 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 | Ca3(PO4)2 |
| Ksp | 2.8×10-9 | 7.1×10-5 | 5.6×10-12 | 6.8×10-6 | 2.1×10-33 |
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为

(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


