解答题-原理综合题 较难0.4 引用1 组卷267
碳、氮及其化合物在生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
CH4(g) + 4NO(g) 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=____ 。
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____ (填字母)。
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA___ KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些___________ 。
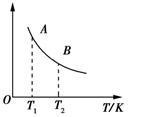
a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
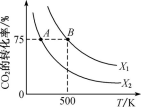
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是____ (填字母)。
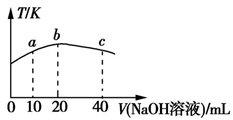
a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g)
 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;CH4(g) + 4NO(g)
 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g)
 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA

a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是

a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
17-18高二上·山西·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
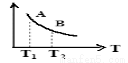
 6FeO(s)+O2(g) ΔH=a kJ·mol-1
6FeO(s)+O2(g) ΔH=a kJ·mol-1 2CO(g)+2H2(g) ΔH>0,下列说法正确的是
2CO(g)+2H2(g) ΔH>0,下列说法正确的是