解答题-实验探究题 适中0.65 引用1 组卷108
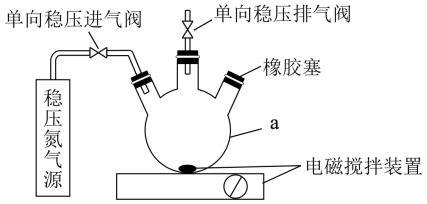
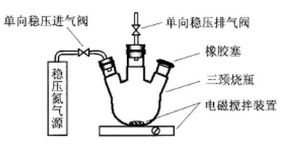
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1,我国《地表水环境质量标准》规定,生活饮用水源DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水DO。
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2;①2Mn2++O2+4OH-=2MnO(OH)2↓,酸性条件下,MnO(OH)2将I-氧化为I2;②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2,③2S2O32-+I2=S4O62-+2I-。
Ⅱ.测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2.。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL MnSO4无氧溶液(过量)2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d.搅拌并向烧瓶中加入2mLH2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000ml·L-1Na2SO3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。
回答下列问题
(1)配制以上无氧溶液时,除去所用溶剂水中氧的简单操作为_____________ 。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为___________________ 。
①滴定管②注射器③量筒
(3)步骤f为_________________ 。
(4)步骤e中达到滴定终点的标志为__________________ 。若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=________ mg·L-1(保留一位小数)。若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则所测的值_________ (填:偏高、偏低、无影响)

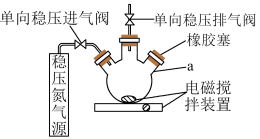
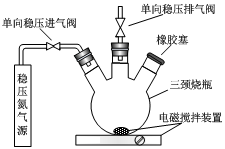
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2;①2Mn2++O2+4OH-=2MnO(OH)2↓,酸性条件下,MnO(OH)2将I-氧化为I2;②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2,③2S2O32-+I2=S4O62-+2I-。
Ⅱ.测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2.。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL MnSO4无氧溶液(过量)2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d.搅拌并向烧瓶中加入2mLH2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000ml·L-1Na2SO3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。
回答下列问题
(1)配制以上无氧溶液时,除去所用溶剂水中氧的简单操作为
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为
①滴定管②注射器③量筒
(3)步骤f为
(4)步骤e中达到滴定终点的标志为
17-18高二上·江西抚州·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网