填空题 较难0.4 引用2 组卷203
利用可再生能源代替石油和煤已经成为未来发展的趋势,甲醇作为重要的可再生能源具有广泛的开发和应用前景。工业上常利用反应CO(g)+2H2(g) ⇌CH3OH(g) △H<0来合成甲醇。
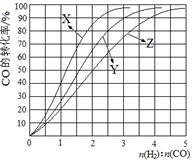
(1)经研究发现在230℃~270℃时合成最为有利。为探寻合成气最合适的起始组成比,分别在230℃、250℃和270℃时进行实验,实验结果如图。230℃的实验结果所对应的曲线是_______ (填字母); 从提高CO转化率的角度等综合分析,该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是_________ (填字母)。
A.1~1.5 B.2.5~3 C.3.5~4.5
(2)制甲醇所需要的氢气,可通过下列反应制取:H2O(g)+CO(g)⇌H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。回答下列问题:
①该温度下,若起始时c(CO)=2mol·L—1,c(H2O)=3mol·L-1,反应进行一段时间后,测得CO的浓度为1mol·L-1,则此时该反应v(正)____ v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将_____ (填“增大”、“减小”或“不变”)。
(3)甲醇是一种化工原料,工业上合成甲醇的反CO(g)+2H2(g)⇌CH3OH(g) △H=-90.8kJ·mol—1。若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
①容器内压强P:P甲、P乙与P丙的关系是_____________ (用“>”、“<”或“=”表示);
②变化的热量数值Q中, Q1与Q2的和是___________ (填具体数值)。
(1)经研究发现在230℃~270℃时合成最为有利。为探寻合成气最合适的起始组成比,分别在230℃、250℃和270℃时进行实验,实验结果如图。230℃的实验结果所对应的曲线是
A.1~1.5 B.2.5~3 C.3.5~4.5

(2)制甲醇所需要的氢气,可通过下列反应制取:H2O(g)+CO(g)⇌H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。回答下列问题:
①该温度下,若起始时c(CO)=2mol·L—1,c(H2O)=3mol·L-1,反应进行一段时间后,测得CO的浓度为1mol·L-1,则此时该反应v(正)
②若降低温度,该反应的K值将
(3)甲醇是一种化工原料,工业上合成甲醇的反CO(g)+2H2(g)⇌CH3OH(g) △H=-90.8kJ·mol—1。若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
②变化的热量数值Q中, Q1与Q2的和是
17-18高二上·山西大同·期中
类题推荐
甲醇(CH3OH)是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g) △H=-90.8 kJ·mol-1.若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
回答下列问题:
(1)下列说法正确的是___________ (填标号)。
A.c1=c2 B.2Q1=Q3 C.Q1+Q2=90.8 D.α2+α3<1
(4)工业上也可用CO2和H2合成甲醇。将2 mol CO2和6 mol H2充入2 L恒容密闭容器中发生反应:CO2(g)+3H2(g)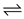 CH3OH(g)+H2O(g),如图1表示压强为0.1 MPa和5.0 MPa下CO2的平衡转化率随温度的变化关系。
CH3OH(g)+H2O(g),如图1表示压强为0.1 MPa和5.0 MPa下CO2的平衡转化率随温度的变化关系。
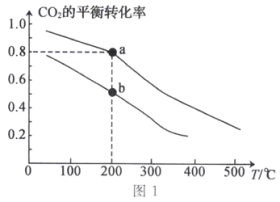
①a、b两点化学反应速率分别用va、vb,表示,则va___________ vb(填“大于”“小于”或“等于”)。
②a点对应的平衡常数K=___________ L2·mol-2(保留1位小数)。
(5)在1 L恒容密闭容器中投入1 mol CO2和3.75 mol H2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),实验测得不同压强下,平衡时甲醇的物质的量随温度的变化如图2所示。
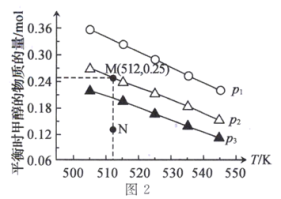
下列说法正确的是___________ (填标号)。
A.压强大小关系为p1<p2<p3
B.M点时,H2的平衡转化率为20%
C.升高温度,平衡常数增大
D.在p2及512 K时,图中N点的正反应速率大于逆反应速率
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CO、4 mol H2 |
| 平衡时的浓度 | c1 | c2 | c3 |
| 平衡时反应的能量变化为正值 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡时反应物的转化率 | α1 | α2 | α3 |
回答下列问题:
(1)下列说法正确的是
A.c1=c2 B.2Q1=Q3 C.Q1+Q2=90.8 D.α2+α3<1
(4)工业上也可用CO2和H2合成甲醇。将2 mol CO2和6 mol H2充入2 L恒容密闭容器中发生反应:CO2(g)+3H2(g)
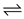 CH3OH(g)+H2O(g),如图1表示压强为0.1 MPa和5.0 MPa下CO2的平衡转化率随温度的变化关系。
CH3OH(g)+H2O(g),如图1表示压强为0.1 MPa和5.0 MPa下CO2的平衡转化率随温度的变化关系。
①a、b两点化学反应速率分别用va、vb,表示,则va
②a点对应的平衡常数K=
(5)在1 L恒容密闭容器中投入1 mol CO2和3.75 mol H2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),实验测得不同压强下,平衡时甲醇的物质的量随温度的变化如图2所示。

下列说法正确的是
A.压强大小关系为p1<p2<p3
B.M点时,H2的平衡转化率为20%
C.升高温度,平衡常数增大
D.在p2及512 K时,图中N点的正反应速率大于逆反应速率
甲醇(CH3OH)是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g) △H=-90.8 kJ·mol-1.若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
回答下列问题:
(1)下列说法正确的是___________ (填标号)。
A.c1=c2 B.2Q1=Q3 C.Q1+Q2=90.8 D.α2+α3<1
(2)据研究,反应过程中起催化作用的是Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是___________ (用化学方程式表示)。
(3)已知在25℃,101 kPa下:甲醇(l)的燃烧热△H=-725.8 kJ·mol-1,CO(g)的燃烧热△H=-283 kJ·mol-1,H2O(g)=H2O(l) △H=-44.0 kJ·mol-1。
则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为___________ 。
(4)工业上也可用CO2和H2合成甲醇。将2 mol CO2和6 mol H2充入2 L恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图1表示压强为0.1 MPa和5.0 MPa下CO2的平衡转化率随温度的变化关系。
CH3OH(g)+H2O(g),如图1表示压强为0.1 MPa和5.0 MPa下CO2的平衡转化率随温度的变化关系。
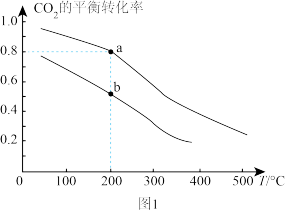
①a、b两点化学反应速率分别用va、vb,表示,则va___________ vb(填“大于”“小于”或“等于”)。
②a点对应的平衡常数K=___________ L2·mol-2(保留1位小数)。
(5)在1 L恒容密闭容器中投入1 mol CO2和3.75 mol H2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),实验测得不同压强下,平衡时甲醇的物质的量随温度的变化如图2所示。
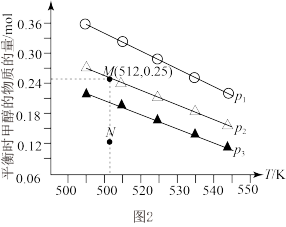
下列说法正确的是___________ (填标号)。
A.压强大小关系为p1<p2<p3
B.M点时,H2的平衡转化率为20%
C.升高温度,平衡常数增大
D.在p2及512 K时,图中N点的正反应速率大于逆反应速率
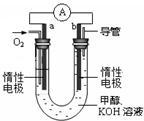
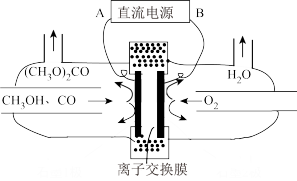
(6)以甲醇为主要原料,电化学合成碳酸二甲酯[(CH3O)2CO]的工作原理如图所示。直流电源的正极为___________ (填“A”或“B”),阳极的电极反应式为___________ 。
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CO、4 mol H2 |
| 平衡时的浓度 | c1 | c2 | c3 |
| 平衡时反应的能量变化为正值 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡时反应物的转化率 | α1 | α2 | α3 |
(1)下列说法正确的是
A.c1=c2 B.2Q1=Q3 C.Q1+Q2=90.8 D.α2+α3<1
(2)据研究,反应过程中起催化作用的是Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是
(3)已知在25℃,101 kPa下:甲醇(l)的燃烧热△H=-725.8 kJ·mol-1,CO(g)的燃烧热△H=-283 kJ·mol-1,H2O(g)=H2O(l) △H=-44.0 kJ·mol-1。
则甲醇(l)不完全燃烧生成一氧化碳和水蒸气的热化学方程式为
(4)工业上也可用CO2和H2合成甲醇。将2 mol CO2和6 mol H2充入2 L恒容密闭容器中发生反应:CO2(g)+3H2(g)

①a、b两点化学反应速率分别用va、vb,表示,则va
②a点对应的平衡常数K=
(5)在1 L恒容密闭容器中投入1 mol CO2和3.75 mol H2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),实验测得不同压强下,平衡时甲醇的物质的量随温度的变化如图2所示。

下列说法正确的是
A.压强大小关系为p1<p2<p3
B.M点时,H2的平衡转化率为20%
C.升高温度,平衡常数增大
D.在p2及512 K时,图中N点的正反应速率大于逆反应速率
(6)以甲醇为主要原料,电化学合成碳酸二甲酯[(CH3O)2CO]的工作原理如图所示。直流电源的正极为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网