填空题 较难0.4 引用2 组卷465
合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
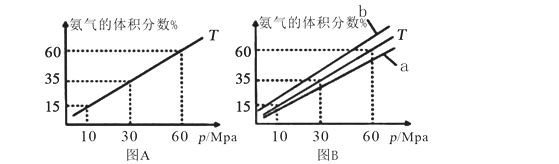
①图A中氨气的体积分数为15%时,H2的转化率为_______ 。
②图B中T=500℃,则温度为450℃时对应的曲线是_______ (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
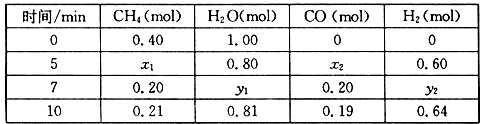
①分析表中数据,判断5 min时反应是否处于平衡状态?_____ (填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________ 。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________ (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________ 。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______ 。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
①当压强从2×105 Pa增加到5×105 Pa时,平衡______ 移动(填“正向、逆向或不”)。
②当压强为1×106 Pa时,此反应的平衡常数表达式为______________ 。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为
②图B中T=500℃,则温度为450℃时对应的曲线是
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
①分析表中数据,判断5 min时反应是否处于平衡状态?
②该温度下,上述反应的平衡常数K=
③反应在7~10 min内,CO的物质的量减少的原因可能是
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)
 CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)
 pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105 Pa增加到5×105 Pa时,平衡
②当压强为1×106 Pa时,此反应的平衡常数表达式为
17-18高二上·四川成都·阶段练习
类题推荐
I.甲醇气相脱水制甲醚(CH3OCH3)的反应可表示为: 2 CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是_______。
(2)200 ℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如下表:
① 10~30 min内,用CH3OCH3(g)表示该反应的平均速率为_______ 。
② CH3OH(g)的平衡转化率为_______ 。
③ 200 ℃时,向该容器中投入三种成分的浓度如下:
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)_______ v逆(CH3OH)(填“>”“<”或“=”)。
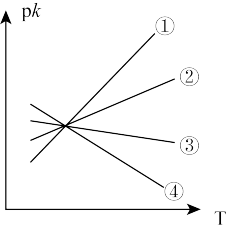
(3)若其正、逆反应速率分别可表示为v正=k正c2(CH3OH)、v逆=k逆c (CH3OCH3)·c (H2O),k正、k逆 分别为正、逆反应速率常数,只与温度有关。则如图(pk=-lgk)所示①、②、③、④四条斜线中,能表示pk正随温度T变化关系的是斜线_______ 。
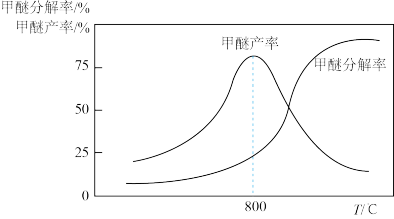
(4)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如下图所示,试解释800 ℃之后甲醇脱水制甲醚产率降低的主要原因为_______ 。
II.在容积可变的密闭容器中发生反应:mA(g)+nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
(5)当压强从2×105增加到时5×105,平衡_______ 移动。(填“正向”、“逆向”或“不”)
(6)当压强为1×106时,写出此时反应的平衡常数表达式:K =_______ 。
(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是_______。
| A.CH3OCH3(g)和H2O(g)的浓度比保持不变 | B.v正(CH3OH)=2v逆(CH3OCH3) |
| C.容器内压强不再变化 | D.混合气体的平均相对分子质量不再变化 |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
② CH3OH(g)的平衡转化率为
③ 200 ℃时,向该容器中投入三种成分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol·L-1) | 0.64 | 0.68 | 0.68 |
(3)若其正、逆反应速率分别可表示为v正=k正c2(CH3OH)、v逆=k逆c (CH3OCH3)·c (H2O),k正、k逆 分别为正、逆反应速率常数,只与温度有关。则如图(pk=-lgk)所示①、②、③、④四条斜线中,能表示pk正随温度T变化关系的是斜线

(4)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如下图所示,试解释800 ℃之后甲醇脱水制甲醚产率降低的主要原因为

II.在容积可变的密闭容器中发生反应:mA(g)+nB(g)
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/(mol/L) | 0.08 | 0.20 | 0.44 |
(6)当压强为1×106时,写出此时反应的平衡常数表达式:K =
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
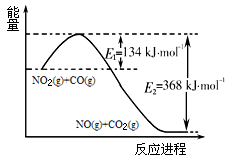
(1)根据下面的能量变化示意图,请写出NO2和CO反应的热化学方程式__________________ 。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H < 0 ,
2NH3(g) △H < 0 ,
其平衡常数K与温度T的关系如下表:
①该反应的平衡常数表达式:K=___________________________
②试判断K1______ K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是_______ (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是___________ 。

a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=____________ ,以NH3表示该过程的反应速率v(NH3)= ______________ 。
(1)根据下面的能量变化示意图,请写出NO2和CO反应的热化学方程式

(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
①该反应的平衡常数表达式:K=
②试判断K1
③下列各项能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g)

a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=
氮是生产硝酸、尿素等物质的重要原料。
(1)氨催化氧化法是工业制硝酸的主要方法。已知:
2NO(g)+3H2(g) 2NH3(g)+02(g) △H1=-272.9kJ/mol
2NH3(g)+02(g) △H1=-272.9kJ/mol
2H2(g)+02(g) 2H2O(g) △H2=-483.6kJ/mol
2H2O(g) △H2=-483.6kJ/mol
则4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H3=
4NO(g)+6H2O(g) △H3=__________
(2)恒容密闭容器中进行合成知反应:N2(g)+3H2(g) 2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
K1____ K2(填“>”或“<”),其判断理由是_____________ 。
(3)向氨合成塔中充入10molN2和40molH2合成氨,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。
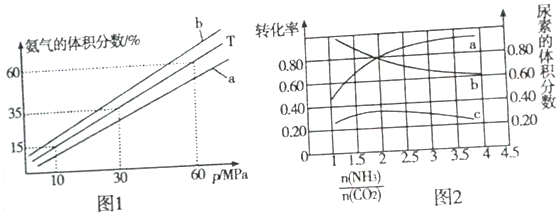
①下列说法正确的是______ (填字母)。
A.由图1可知增大体系压强(p)有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度的主要目的是提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
②当温度为T、氨气的体积分数为25%时,N2的转化率为__________ 。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后得到溶液中溶质的质量分数为_______ 。
(5)氮碳比[ ]对合成尿素的反应:2NH3(g)+CO2(g)
]对合成尿素的反应:2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当
CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当 =
=_______ 时,尿素的产量最大,该条件下反应的平衡常数K=________ 。
(1)氨催化氧化法是工业制硝酸的主要方法。已知:
2NO(g)+3H2(g)
 2NH3(g)+02(g) △H1=-272.9kJ/mol
2NH3(g)+02(g) △H1=-272.9kJ/mol 2H2(g)+02(g)
 2H2O(g) △H2=-483.6kJ/mol
2H2O(g) △H2=-483.6kJ/mol则4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H3=
4NO(g)+6H2O(g) △H3=(2)恒容密闭容器中进行合成知反应:N2(g)+3H2(g)
 2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:| 温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×106 | K1 | K2 | … |
K1
(3)向氨合成塔中充入10molN2和40molH2合成氨,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。

①下列说法正确的是
A.由图1可知增大体系压强(p)有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度的主要目的是提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
②当温度为T、氨气的体积分数为25%时,N2的转化率为
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后得到溶液中溶质的质量分数为
(5)氮碳比[
 CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当
CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


