解答题-原理综合题 适中0.65 引用1 组卷159
碳及其化合物在化工生产中有着广泛的应用。
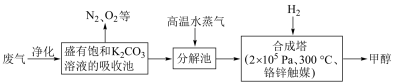
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:
把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。
部分技术流程如下:
⑴合成塔中反应的化学方程式为____________ ;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了___________________________________________________________________ 。
(2)从合成塔分离出甲醇的原理与下列_______ 操作的原理比较相符(填字母)
A.过滤B.分液C.蒸馈D.结晶
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式:
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ/mol
_______________________________________________________________________ 。
II.甲烷燃烧会放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1=-1214.6kJ/mol
②CO2(g)=CO(g)+1/2O2(g);△H2=+283.0kJ/mol
则表示甲烷燃烧热的热化学方程式______________________________ 。
III.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g) CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO 2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO 2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
(1)从反应开始到20min时,以CO表示反应速率为_____________________ 。
(2)下列描述能说明反应达到平衡的是_______________________
A.装置内气体颜色不再改变B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变D.容器内气体密度保持不变
(3)该温度下平衡常数K=____ ,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将____ (填“增大”、“减小”或“不变”)
(4)该反应达到平衡后,再向容器中充入1mol CO 2mol H2,此时CO的转化率将__________ (填“增大”、“减小”或“不变”)
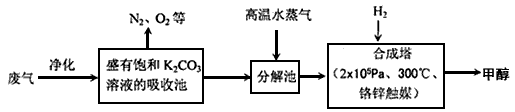
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:
把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。
部分技术流程如下:

⑴合成塔中反应的化学方程式为
(2)从合成塔分离出甲醇的原理与下列
A.过滤B.分液C.蒸馈D.结晶
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式:
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ/mol
II.甲烷燃烧会放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1=-1214.6kJ/mol
②CO2(g)=CO(g)+1/2O2(g);△H2=+283.0kJ/mol
则表示甲烷燃烧热的热化学方程式
III.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)
 CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO 2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO 2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)从反应开始到20min时,以CO表示反应速率为
(2)下列描述能说明反应达到平衡的是
A.装置内气体颜色不再改变B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变D.容器内气体密度保持不变
(3)该温度下平衡常数K=
(4)该反应达到平衡后,再向容器中充入1mol CO 2mol H2,此时CO的转化率将
17-18高二上·安徽六安·阶段练习
类题推荐
(12分)为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下

(1)合成塔中反应的化学方程式为_____________ ;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了________________ 。
(2)从合成塔分离出甲醇的原理与下列______ 操作的原理比较相符(填字母)
工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括__________ .
(3)在体积为2L的合成塔中,充人2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
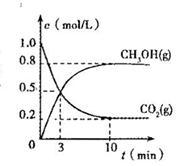
从反应开始到平衡,V(H2) =______________ ;能使平衡体系中nCH3OH)/n(CO2)增大的措施有____________ 。
A、加入催化剂
B、充入He(g),使体系压强增大
C、将H2O(g)从体系中分离
D、降低温度
(4) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知CH4(g) + 2O2(g)=CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
H2(g) + 1/2O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式________________ 。

(1)合成塔中反应的化学方程式为
(2)从合成塔分离出甲醇的原理与下列
| A.过滤 | B.分液 | C.蒸馏 | D.结晶 |
(3)在体积为2L的合成塔中,充人2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡,V(H2) =
A、加入催化剂
B、充入He(g),使体系压强增大
C、将H2O(g)从体系中分离
D、降低温度
(4) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知CH4(g) + 2O2(g)=CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
H2(g) + 1/2O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
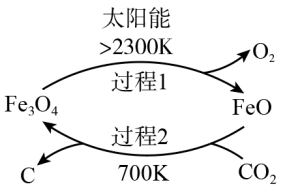
二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示,其总反应的化学方程式为_______ 。
(2)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图。(丙烯的结构简式:CH3CH=CH2)
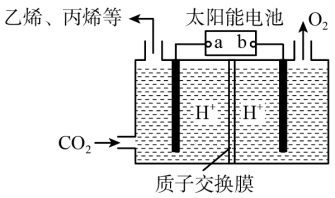
①b电极的名称是_______ ;
②产生丙烯的电极反应式为_______ 。
(3)某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g) CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
①从反应开始到20min时,以CO表示反应速率为_______ 。
②下列描述能说明反应达到平衡的是_______ 。
A.装置内CO和H2的浓度比值不再改变
B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变
D.容器内气体密度保持不变
③该温度下平衡常数K=_______ ,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将_______ (填“增大”、“减小”或“不变”)
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示,其总反应的化学方程式为

(2)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图。(丙烯的结构简式:CH3CH=CH2)

①b电极的名称是
②产生丙烯的电极反应式为
(3)某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
②下列描述能说明反应达到平衡的是
A.装置内CO和H2的浓度比值不再改变
B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变
D.容器内气体密度保持不变
③该温度下平衡常数K=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网