解答题-工业流程题 适中0.65 引用2 组卷383
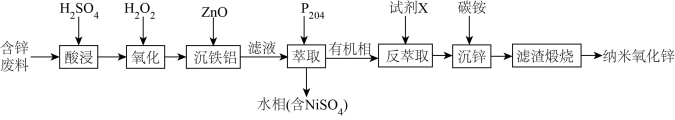
金属镍硬而有延展性并具有铁磁性,能够高度磨光和抗腐蚀。下图是一种以含镍废料(主要是NiO,含少量FeO、SiO2等杂质)制备Ni的流程:
(1)滤渣1的主要成分为_____________ (填化学式)。
(2)实验中需用0.8mol/L的稀硫酸800mL,若用98%的浓硫酸(ρ=1.84g·mL-l)来配制,量取浓硫酸
时,需使用的量筒的规格为_________ (填序号)。
A.10mL B.20mL C.50mL D.l00tnL
(3)用离子方程式解释加入H2O2的作用:_________________ 。
(4)滴加氨水调节至pH为_________ 时,铁刚好沉淀完全;若继续滴加氨水至pH为_____________ 时,镍开始沉淀(假定Ni2+浓度为0.lmol/L)。若上述过程中没有“氧化”步骤,其后果是_______________ 。
(5)电解制备镍的反应原理如图所示,则A电极的反应式为2H++2e-=H2↑和___________________ 。 _____________ 。
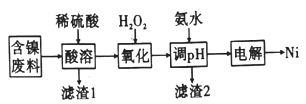
化合物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-15 | 10-15 | 10-38 |
(2)实验中需用0.8mol/L的稀硫酸800mL,若用98%的浓硫酸(ρ=1.84g·mL-l)来配制,量取浓硫酸
时,需使用的量筒的规格为
A.10mL B.20mL C.50mL D.l00tnL
(3)用离子方程式解释加入H2O2的作用:
(4)滴加氨水调节至pH为
(5)电解制备镍的反应原理如图所示,则A电极的反应式为2H++2e-=H2↑和
16-17高三·云南·阶段练习
类题推荐
某工业生产上用铜镍矿石(主要成分为CuS、NiS、FeS、SiO2及不溶于酸的杂质)制备胆矾CuSO4•5H2O的流程如图。

已知:有机萃取剂HR可以萃取Cu2+,其萃取原理(org为有机相)Cu2+(aq)+2HR(org) CuR2(org)+2H+(aq)。
CuR2(org)+2H+(aq)。
(1)焙烧前粉碎的目的是_______ 。
(2)“调节pH时,生成氢氧化铁沉淀的离子方程式为_______ ,试剂X的最佳选择是_______ (填标号)。
a.HCl b.NaOH c.H2SO4 d.NH3•H2O
(3)25℃时,“调节pH”后,测得滤液中各离子浓度及相关数据如表所示。(lg2=0.3)
该滤液的pH为_______ ;加入的Cu(OH)2_______ (填“已经”或“没有”)完全溶解。
(4)向“萃取”后的水相中加入一定量的NaClO和NaOH,能制得黑色不溶物NiOOH,该反应的化学方程式为_______ 。
(5)“操作Ⅱ”包括洗涤,洗涤该沉淀的操作为_______ 。
(6)上述流程中获取金属铜的方法是电解硫酸铜溶液。若电解200mL 0.5mol/L CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是_______ 。

已知:有机萃取剂HR可以萃取Cu2+,其萃取原理(org为有机相)Cu2+(aq)+2HR(org)
(1)焙烧前粉碎的目的是
(2)“调节pH时,生成氢氧化铁沉淀的离子方程式为
a.HCl b.NaOH c.H2SO4 d.NH3•H2O
(3)25℃时,“调节pH”后,测得滤液中各离子浓度及相关数据如表所示。(lg2=0.3)
| 离子 | Fe3+ | Cu2+ | Ni2+ | Fe2+ |
| 浓度/(mol·L-1) | 1.0×10-6 | 5.0 | 1.2 | 0 |
| 对应氢氧化物的Ksp | 6.4×10-38 | 2.2×10-20 | 2.0×10-15 | 8.0×10-16 |
(4)向“萃取”后的水相中加入一定量的NaClO和NaOH,能制得黑色不溶物NiOOH,该反应的化学方程式为
(5)“操作Ⅱ”包括洗涤,洗涤该沉淀的操作为
(6)上述流程中获取金属铜的方法是电解硫酸铜溶液。若电解200mL 0.5mol/L CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是
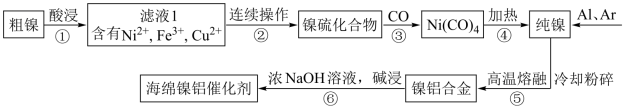
“海绵镍铝催化剂” 是一种多孔的镍铝合金,常用作有机催化剂。现以某粗镍(含Ni、Fe、Cu及难与酸、碱溶液反应的不溶性杂质)为原料制取该催化剂,主要流程如下:
已知:25℃时,以0.1mol/L金属离子测定得到如下数据:
根据信息回答:
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式__________ 。
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是______________ 。
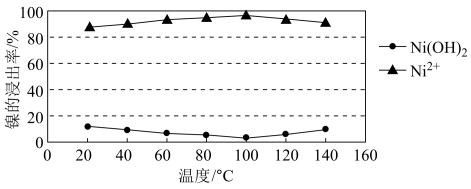
(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物。为达到此目的,应先加NaOH将溶液调节至_______ (填pH的取值范围);再加_______ (选填最佳试剂的序号)。当溶液中Ni2+开始形成NiS时,c(Cu2+)_______ 。(忽略溶液体积变化)
A.硝酸 B.氨水 C. A12S3D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为______ ;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni。ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为_____________ 。
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为___________________ 。

已知:25℃时,以0.1mol/L金属离子测定得到如下数据:
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 | |
Ksp | 6×10-36 | 3×10-19 | ||||
pH | 开始沉淀 | 4.7 | 7.2 | 1.9 | ||
沉淀完全 | 6.7 | 9.2 | 3.2 | |||
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是

(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物。为达到此目的,应先加NaOH将溶液调节至
A.硝酸 B.氨水 C. A12S3D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网