解答题-原理综合题 适中0.65 引用1 组卷265
CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g)ΔH2=-483.6 kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g)ΔH3=131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的ΔH=________ kJ·mol-1。标准状况下的煤气(CO、H2)44.8 L与氧气反应生成CO2和H2O,反应过程中转移________ mol电子。
(2)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:
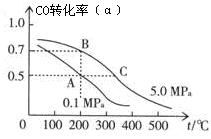
CO(g)+2H2(g) CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在B点时容器的体积为6 L,则该温度下的平衡常数K=________ ;此时在A点时容器的体积VA_______ 6 L(填“大于”“小于”或“等于”)。该反应为________ (填“放热反应”或“吸热反应”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________ tC(填“大于”“小于”或“等于”)。
(1)已知:C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g)ΔH2=-483.6 kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g)ΔH3=131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的ΔH=
(2)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)
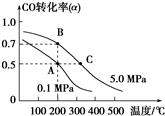
 CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在B点时容器的体积为6 L,则该温度下的平衡常数K=
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA
16-17高二下·福建福州·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
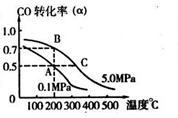
 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
 CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。