解答题-结构与性质 适中0.65 引用1 组卷301
铜镍合金曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)铜元素基态原子的电子排布式为_________ ,3d能级上的未成对电子数为_________ 。
(2)氢氧化铜与氨水作用形成[Cu(NH3)4](OH)2深蓝色溶液。
①[Cu(NH3)4](OH)2中阳离子的立体构型是_________ 。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为_______________ ,提供孤电子对的成键原子是_______________ 。
③氨可以形成的晶体属于_______ 晶体(填晶体类型),其结构中的氮原子只能形成_______ 个氮氢键,其原因是______________________________________ 。
(3)N原子的第一电离能IN=l402.3kJ/mol,0原子的第一电离能I0=1313.9kJ/mol。IN>I0的原因是_____________________________ 。
(4)单质铜及镍都是由__________ 键形成的晶体。
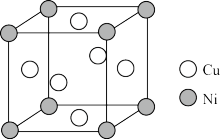
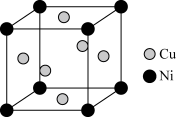
(5)铜镍合金的立方晶胞结构如图所示。
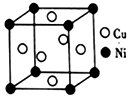
①晶胞中镍原子与铜原子的数量比为_______ 。
②若合金的密度为dg/cm3,晶体中任意―个Ni原子到最近Cu原子的距离为_______ cm(设NA为阿伏伽德罗常数的值)。
(1)铜元素基态原子的电子排布式为
(2)氢氧化铜与氨水作用形成[Cu(NH3)4](OH)2深蓝色溶液。
①[Cu(NH3)4](OH)2中阳离子的立体构型是
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为
③氨可以形成的晶体属于
(3)N原子的第一电离能IN=l402.3kJ/mol,0原子的第一电离能I0=1313.9kJ/mol。IN>I0的原因是
(4)单质铜及镍都是由
(5)铜镍合金的立方晶胞结构如图所示。

①晶胞中镍原子与铜原子的数量比为
②若合金的密度为dg/cm3,晶体中任意―个Ni原子到最近Cu原子的距离为
17-18高三上·云南·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网