解答题-原理综合题 适中0.65 引用2 组卷262
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料,而氢气、二甲醚等都是很有发展前景的新能源。
(1)在25℃、101kPa时,1gCH4完全燃烧生成液态水时放出的热量是55.64 kJ,则表示甲烷燃烧热的热化学方程式是___________________________________________ 。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ· mol-1,已知CO气体燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-565.14 kJ·mol-1,试计算相同物质的量的C3H8和CO燃烧产生的热量的比值________ (保留小数点后一位)。
(3)氢气既能与氮气发生反应又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1
3H2(g)+N2(g) 2NH3(g) ΔH=-92.4 kJ· mol-1
2NH3(g) ΔH=-92.4 kJ· mol-1
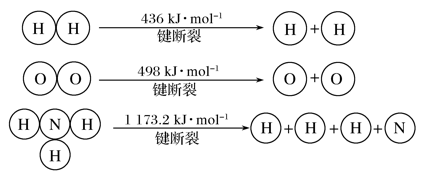
计算断裂1 mol N≡N键需要消耗能量________ kJ。
(4)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+2H2(g)===CH3OH(g) ΔH1=-90.1 kJ· mol-1
②CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH2=-49.0 kJ· mol-1
水煤气变换反应:③CO(g)+H2O(g)===CO2(g)+H2(g) ΔH3=-41.1 kJ· mol
二甲醚合成反应:④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ· mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_______________________ 。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:_________________________________________________ 。
(1)在25℃、101kPa时,1gCH4完全燃烧生成液态水时放出的热量是55.64 kJ,则表示甲烷燃烧热的热化学方程式是
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ· mol-1,已知CO气体燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-565.14 kJ·mol-1,试计算相同物质的量的C3H8和CO燃烧产生的热量的比值
(3)氢气既能与氮气发生反应又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1
3H2(g)+N2(g)
 2NH3(g) ΔH=-92.4 kJ· mol-1
2NH3(g) ΔH=-92.4 kJ· mol-1
计算断裂1 mol N≡N键需要消耗能量
(4)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+2H2(g)===CH3OH(g) ΔH1=-90.1 kJ· mol-1
②CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH2=-49.0 kJ· mol-1
水煤气变换反应:③CO(g)+H2O(g)===CO2(g)+H2(g) ΔH3=-41.1 kJ· mol
二甲醚合成反应:④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ· mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
2017高三·江苏·专题练习
类题推荐
化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)在101kPa时,1.6gCH4完全燃烧生成CO2和液态H2O,放出89.0kJ的热量,CH4的燃烧热为___________ kJ·mol-1,写出CH4燃烧热的热化学方程式:___________ ,89.6LCH4(标况)完全燃烧(产物水为液态)后所产生的热量为___________ kJ
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。已知反应N2(g)+3H2(g) 2NH3(g) ΔH=akJ·mol-1
2NH3(g) ΔH=akJ·mol-1
试根据表中所列键能数据计算a的数值:___________ 。
(3)已知:C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1③
根据盖斯定律,请写出25℃、101kPa时由C(石墨,s)和H2(g)生成1molC2H2(g)反应的热化学方程式:___________ 。
(4)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下三个反应:
甲醇合成反应:
①CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1kJ·mol-1
水煤气变换反应:
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1
二甲醚合成反应:
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:___________
(1)在101kPa时,1.6gCH4完全燃烧生成CO2和液态H2O,放出89.0kJ的热量,CH4的燃烧热为
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。已知反应N2(g)+3H2(g)
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ·mol-1) | 436 | 391 | 945 |
(3)已知:C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1③
根据盖斯定律,请写出25℃、101kPa时由C(石墨,s)和H2(g)生成1molC2H2(g)反应的热化学方程式:
(4)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下三个反应:
甲醇合成反应:
①CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1kJ·mol-1
水煤气变换反应:
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1
二甲醚合成反应:
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2NH3(g) ΔH=-92.4 kJ· mol-1
2NH3(g) ΔH=-92.4 kJ· mol-1


