解答题-原理综合题 较难0.4 引用1 组卷300
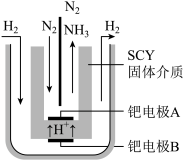
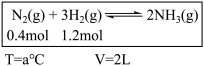
(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器进行合成氨反应,如下图(图中所示数据为初始物理量)。t分钟后反应达到平衡,生成的NH3为0.4 mol。
①判断甲容器中的反应达平衡的依据是___________ (填字母)。
A.压强不随时间改变
B.气体的 密度不随时间改变
密度不随时间改变
C.c(N2)不随时间改变
D.单位时间内生成2 mol NH3的同时消耗1 mol N2
E.单位时间内断裂3 mol H—H键,同时断裂6 mol N—H键
H—H键,同时断裂6 mol N—H键
②该条件下甲容器中反应的平衡常数K=________ ;平衡时,甲的压强p平= _______ (用初始压强p0表示)。
(2)最近华南理工大学提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如下图所示。
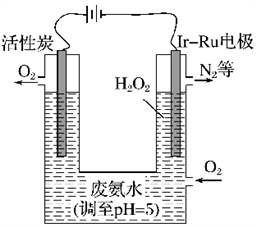
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的 pH约为5,则所得废氨水溶液中c(NH
pH约为5,则所得废氨水溶液中c(NH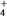 )
)__________ (填“>”“<”或“=”)c(NO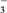 )。
)。
②IrRu惰性电极有吸附O2的作用,该电极上的反应为_____________________________________________ 。
③理论上电路中每转移3 mol电子,最多可以处理NH3·H2O的物质的量为________ 。

①判断甲容器中的反应达平衡的依据是
A.压强不随时间改变
B.气体的
 密度不随时间改变
密度不随时间改变C.c(N2)不随时间改变
D.单位时间内生成2 mol NH3的同时消耗1 mol N2
E.单位时间内断裂3 mol
 H—H键,同时断裂6 mol N—H键
H—H键,同时断裂6 mol N—H键②该条件下甲容器中反应的平衡常数K=
(2)最近华南理工大学提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如下图所示。

①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的
 pH约为5,则所得废氨水溶液中c(NH
pH约为5,则所得废氨水溶液中c(NH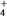 )
)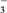 )。
)。②IrRu惰性电极有吸附O2的作用,该电极上的反应为
③理论上电路中每转移3 mol电子,最多可以处理NH3·H2O的物质的量为
2017高三上·浙江·专题练习
类题推荐
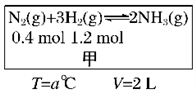
(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
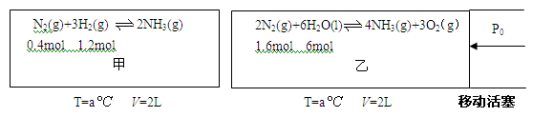
①判断甲容器中的反应达平衡的依据是_________ .(填写相应编号)
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K=________
③该条件下,若向乙中继续加入0.2mol N2,达到新平衡时N2转化率=___________ 。
(2)某甲醇(CH3OH)燃料电池原理如图1所示。
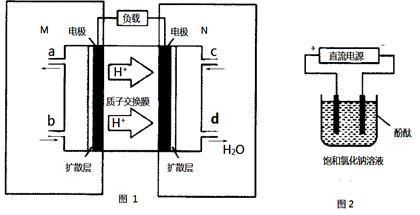
①M区发生反应的电极反应式为_______________________________ .
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解池的总反应离子方程式为:_____________________________________ . 假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________ (忽略溶液体积变化).
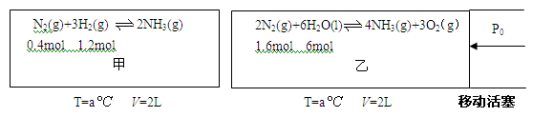
①判断甲容器中的反应达平衡的依据是
| A.压强不随时间改变 |
| B.气体的密度不随时间改变 |
| C.c(N2)不随时间改变 |
| D.单位时间内生成2molNH3的同时消耗1molN2 |
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K=
③该条件下,若向乙中继续加入0.2mol N2,达到新平衡时N2转化率=
(2)某甲醇(CH3OH)燃料电池原理如图1所示。

①M区发生反应的电极反应式为
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解池的总反应离子方程式为:
NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g) 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g) 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是_________ 。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O) 时,说明反应已达平衡
C.当容器内 =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.当测得容器内的O2密度不再变化时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
① 该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2 4NO(g) +6H2O(g)的平衡常数K=
4NO(g) +6H2O(g)的平衡常数K=__________ ( 不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有______________
A.使用催化剂Cu/TiO2 B.将反应生成的H2O(g)及时移出
C.增大NH3和O2的初始投料比 D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图:
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)______ c(NO3﹣)(填“>”、“<”或“=”).
②Ir﹣Ru惰性电极有吸附O2作用,该电极上的反应为______ .
③理论上电路中每转移3mol电子,最多可以处理NH3•H2O的物质的量为______ .
反应I:4NH3(g) +5O2(g)
 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1反应 II:4NH3(g)+3O2(g)
 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H (1)
| 化 学 键 | H—O | O=O | N≡N | N—H |
| 键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=
(2)在恒温恒容装置中充入一定量的NH3和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O) 时,说明反应已达平衡
C.当容器内
D.当测得容器内的O2密度不再变化时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
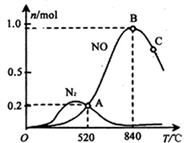
① 该催化剂在高温时选择反应
② 520℃时,4NH3(g)+5O2
 4NO(g) +6H2O(g)的平衡常数K=
4NO(g) +6H2O(g)的平衡常数K=③有利于提高NH3转化为N2平衡转化率的措施有
A.使用催化剂Cu/TiO2 B.将反应生成的H2O(g)及时移出
C.增大NH3和O2的初始投料比 D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图:

①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)
②Ir﹣Ru惰性电极有吸附O2作用,该电极上的反应为
③理论上电路中每转移3mol电子,最多可以处理NH3•H2O的物质的量为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网